В современных условиях наиболее распространенными химическими источниками тока являются гальванические элементы. Несмотря на их отдельные недостатки, они получили широкое распространение в электронике, проводится постоянная работа по их совершенствованию. Принцип работы гальванического элемента достаточно прост. В водный раствор серной кислоты погружаются медная и цинковая пластины, которые, затем, играют роль положительного и отрицательного полюса. При соединении полюсов с помощью проводника происходит появление простейшей электрической цепи. Протекание тока внутри элемента будет происходить от отрицательного заряда к положительному, то есть от цинковой пластины к медной. Движение заряженных частиц по внешней цепи будет осуществляться в обратном направлении. При воздействии электрического тока движение остатков серной кислоты, а также ионов водорода будет происходить в различных направлениях. При этом, водород передает заряд на медную пластину, а остаток кислоты – на цинковую пластину. Таким образом, на клеммах будет осуществляться поддержка напряжения. Одновременно, на медной пластине оседают пузырьки водорода, ослабляющего общее действие элемента и создающего дополнительное напряжение. Такое напряжение известно, как электродвижущая сила поляризации. Чтобы избежать этого явления, в состав вводится вещество, способное поглощать атомы водорода и выполнять функцию деполяризации. Для изготовления современных гальванических элементов используются самые различные материалы. Наиболее распространенными являются материалы на основе угольно-цинковых элементов, используемых для пальчиковых батареек. Их основным положительным качеством считается относительно низкая стоимость. Однако, такие элементы обладают невысокой мощностью и небольшим сроком хранения. Наиболее оптимальным вариантом служит использование щелочных элементов. Здесь в качестве электролита выступает не уголь, а раствор щелочи. При разрядке не происходит выделение газа, что позволяет обеспечить полную герметичность. Щелочные элементы отличаются более высоким сроком хранения. Общий принцип работы гальванического элемента для всех их видов совершенно одинаковый. Например, элементы на основе оксида ртути конструктивно напоминают щелочные. Они отличаются повышенной устойчивостью к высокой температуре, высокой механической прочностью и стабильным значением напряжения. Недостатком является токсичность ртути, требующая осторожного обращения с отработанными элементами. electric-220.ru Самопроизвольно идущий окислительно-восстановительный процесс в определенных условиях может создавать электрическую энергию. Процессы превращения химической энергии в электрическую можно использовать для создания химических источников тока (ХИТ), простейший из которых гальванический элемент. Гальванический элемент состоит из двух электродов, погруженных в электролиты, которые замыкаются электролитическим ключом. КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ Металлический электрод - это металл, погруженный в раствор собственной соли, не является инертным, а участвует в электродной реакции. Cхематично такой электрод записывают в виде Ме|Меn+, где вертикальная черта обозначает границу между металлом и раствором. Уравнение Нернста для металлических электродов имеет вид , (4) где - концентрация ионов металла в растворе, моль/л. Окислительно-восстановительный (редокс-) электрод – это инертный металл (токоподвод), погруженный в электролит, содержащий одновременно окисленную и восстановленную формы потенциалопределяющих частиц. В качестве инертного металла чаще всего используют платину Pt. Схематично такой электрод можно записать в виде Pt│Men+, Mem+. На поверхности инертного металла протекает окислительно-восстановительная реакция. Например, для окислительно-восстановительного электрода Pt│Sn4+, Sn2+ такими реакциями могут быть: Sn2+ - 2 ē → Sn4+; Sn4+ + 2 ē → Sn2+ Уравнение Нернста для редокс- систем включает концентрацию обоих катионов и имеет вид (5) где [окисл], [восст] – концентрации окисленной и восстановленной форм потенциалопределяющих частиц в полуреакции. Газовыеэлектроды состоят из инертного металла, который находится в одновременном контакте с газом и раствором, содержащим ионы этого газа. Представителями газовых электродов являются водородный, кислородный, хлорный и другие электроды. Водородный электрод состоит из платиновой пластинки, покрытой слоем мелкодисперсной платины ("платиновой черни") и погруженной в раствор кислоты, содержащий ионы водорода. Через раствор непрерывно пропускается поток водорода, водород адсорбируется на поверхности платины, и на границе электрод/раствор устанавливается равновесие: H+(раствор) + ē ↔ ½ h3(г) . При давлении водорода, равном 101,3кПа (1 атм), активности (концентрации) ионов водорода 1 моль/л и Т=298К водородный электрод называется стандартным водородным электродом. Потенциал такого электрода принимается за ноль. Уравнение Нернста для водородного электрода имеет вид , (6) где - стандартный электродный потенциал, - концентрация ионов водорода в растворе, моль/л -парциальное давление водорода над раствором, атм. равно 1 атм. Рассмотрим работу гальванического элемента на примере элемента Даниэля-Якоби. Он представляет собой два сосуда с 1М растворами CuSO4 и ZnSO4, в которые погружены соответственно медная и цинковая пластинки, соединенные проводом. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Солевой мостик является электролитическим ключом. Электрод с меньшим значением потенциала заряжается отрицательно, является анодом. Электрод с большим значением потенциала заряжается положительно, является катодом. На аноде протекает процесс окисления (отдача электронов), на катоде – процесс восстановления (присоединение электронов). Гальванические элементы принято записывать в виде схем. Анод со знаком (-) записывают слева, катод со знаком (+) записывают справа. Например, схема медно-цинкового гальванического элемента Даниэля-Якоби может быть представлена таким образом: ē ē (-) Zn|ZnSO4||CuSO4|Cu (+) или (-) Zn|Zn2+||Cu2+|Cu (+) Одна вертикальная черта на схеме обозначает границу между металлом и раствором электролита, две черты – границу между растворами (солевой мостик). При замыкании цепи электроны по внешней цепи пойдут от анода к катоду – от цинка к меди. При этом на электродах протекают следующие реакции: (-) Анод: Zn – 2 ē → Zn2+ реакция окисления (+) Катод: Cu2+ + 2 ē →Cu реакция восстановления Суммируя процессы на катоде и аноде, получаем уравнение окислительно-восстановительной реакции, за счет которой в гальваническом элементе возникает электрический ток: Zn + Cu2+ = Zn2+ + Cu Такое уравнение называется уравнением токообразующей реакции. ЭДС гальванического элемента рассчитывают как разность потенциалов катода и анода: Е = Ек– Еа. Если концентрация ионов в растворе составляет 1 моль/л, то ЭДС называется стандартной. Стандартная ЭДС медно-цинкового элемента при - Пример 7. Рассчитайте ЭДС свинцово-цинкового гальванического элемента при Т = 298К, в котором [Zn2+]=0,1моль/л и [Pb2+]=0,01моль/л. Укажите знаки полюсов, напишите уравнения электродных процессов, составьте схему гальванического элемента. Укажите направление движения электронов при замыкании цепи. Решение: ЭДС гальванического элемента рассчитывают как разность равновесных потенциалов катода и анода: Е= Ек – Еа. Поскольку концентрации потенциалопределяющих ионов отличаются от 1 моль/л, рассчитаем по уравнению Нернста (ур. 4) значения электродных потенциалов цинка и свинца: Электрод с меньшим значением потенциала является анодом (цинковый электрод). На нем протекает реакция окисления: (-) А: Zn – 2 ē → Zn2+ Электрод с большим значением потенциала является катодом (свинцовый электрод), на нем протекает реакция восстановления: (+) К: Pb2+ + 2 ē → Pb Уравнение токообразующей реакции: Zn + Pb2+ → Zn2+ + Pb. Схема гальванического элемента: (-) Zn│Zn2+(0,1M)║Pb2+(0,01M)│Pb (+). Рассчитываем ЭДС гальванического элемента: Е= Ек – Еа = При замыкании цепи, электроны во внешней цепи пойдут от отрицательно заряженного электрода к положительно заряженному электроду, то есть - от цинка к свинцу. Пример 8. Для гальванического элемента Pt│Cr3+ (0,1 моль/л), Cr2+(0,01 моль/л)║Н+(рН=2)│Н2, Pt рассчитать ЭДС, написать уравнения электродных процессов, составить уравнение токообразующей реакции, указать знаки полюсов. Определить направление движения электронов во внешней цепи. Решение: данный гальванический элемент составлен из окислительно- восстановительного и водородного электродов. Потенциал окислительно-восстановительного электрода рассчитываем по уравнению Нернста: Стандартный потенциал пары Сr3+/Cr2+ . Подставив данные условия задачи, рассчитаем потенциал окислительно-восстановительного электрода: . Второй электрод данного гальванического элемента является водородным электродом. Потенциал его, согласно уравнению Нернста: Определяем катод и анод. Поскольку окислительно-восстановительный электрод имеет меньший потенциал, то в гальваническом элементе он будет играть роль анода (отрицательный полюс), а водородный электрод – катода (положительный полюс). После замыкания цепи на первом электроде будет протекать анодный процесс окисления, на втором – катодный процесс восстановления: (-) А : Cr2+ - ē → Cr3+ 2 (+) К: 2 Н+ + 2 ē → Н2 Суммарная токообразующая реакция описывается уравнением 2 Cr2+ + 2 Н+ → 2 Cr3+ + Н2 Электроны при замыкании внешней цепи будут двигаться от отрицательного полюса к положительному: от хромового окислительно-восстановительного электрода к водородному. ЭДС данного элемента Пример 9. Какие процессы протекают на электродах в концентрационном гальваническом элементе, имеющем цинковые электроды, если у одного из электродов концентрация ионов цинка Zn2+ равна 1 моль/л, а у другого – 0,0001 моль/л? Какова ЭДС этого элемента? Напишите схему данного ГЭ. Решение: Концентрационный гальванический элемент состоит из одинаковых электродов, погруженных в растворы своих солей различной концентрации. Определим потенциалы обоих электродов. Так как концентрация ионов цинка у первого электрода равна 1 моль/л, то потенциал его будет равен стандартному потенциалу цинкового электрода: . Потенциал второго электрода рассчитаем по уравнению Нернста: Первый электрод является катодом, на нем после замыкания цепи протекает реакция восстановления (+) К: Zn2+ + 2 ē →Zn Второй электрод, имеющий меньший потенциал, будет анодом, на нем протекает реакция окисления: (-) А: Zn - 2 ē →Zn2+ Токообразующая реакция в гальваническом элементе будет иметь вид: Zn + Zn2+→ Zn + Zn2+ Рассчитываем ЭДС элемента: Е = Ек - Еа = - 0,763 –(-0,881) = 0,122 В. Данный гальванический элемент можно отобразить схемой: (-) Zn│Zn2+(0,0001 моль/л)║Zn2+(1 моль/л)│Zn (+) Задания 4.Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов. 1. Fe| Fe+2 (1моль/л) || Ag+(0,1моль/л) |Ag 2. Cr| Cr+3 (2 моль/л ) || Cd+2 (1 моль/л )|Cd 3. Be| Be+2 (0,1моль/л) || Ni+2 (0,01моль/л) |Ni 4. Mn| Mn+2 (0,1 моль/л ) || Sn+2 (0,01 моль/л )|Sn 5. Al| Al+3 (2 моль/л ) || Cd+2 (0,1 моль/л )|Cd 6. Ni| Ni+2 (0,1 моль/л ) || Cu+2 (0,01 моль/л )|Cu 7. Mg| Mg+2 (1 моль/л ) || Zn+2 (0,01 моль/л )|Zn 8. Cd| Cd+2 (0,1 моль/л ) || Pb+2 (0,01 моль/л )|Pb 9. Fe| Fe+2 (0,01 моль/л ) || Fe+2 (1 моль/л )|Fe 10. Co|Co+2 (0,5 моль/л ) || Ni+2 (0,5 моль/л )|Ni 11. Zn| Zn+2 (1 моль/л ) || Cu+2 (0,01 моль/л )|Cu 12. Pt,h3|H+ (pH=4) || H+ (pH=2)|h3,Pt 13. Al|Al+3 (1 моль/л ) ||Al+3 (2 моль/л )|Al 14. Mn|Mn+2 (1 моль/л ) || Ni+2 (0,01 моль/л )|Ni 15. Ca|Ca+2 (0,1 моль/л) || Fe+2 (0,01 моль/л )|Fe 16. Pb|Pb+2 (1 моль/л ) || Ag+ (0,1 моль/л )|Ag 17. Be|Be+2 (0,001 моль/л ) || Fe+2 (0,001 моль/л )|Fe 18. Pt|Cr+3 (0,1 моль/л ),Cr+2 (0,1 моль/л) || Fe+3 (0,1 моль/л ), Fe+2 (0,1 моль/л)|Pt 19. Zn|Zn+2(1 моль/л ) || Fe+2 (0,01 моль/л)|Fe 20. Al|Al+3 (2 моль/л ) || Cu+2 (0,01 моль/л)|Cu 21. Be|Be+2 (1 моль/л ) || Cd+2 (0,01 моль/л )|Cd 22. Mn|Mn+2 (0,01 моль/л ) || Fe+2 (0,01 моль/л )|Fe 23. Fe|Fe+2 (1 моль/л ) || Sn+2 (0,01 моль/л)|Sn 24. Mg|Mg+2 (0,1 моль/л ) || Ni+2 (0,01 моль/л )|Ni 25. Ag|Ag+ (0,001 моль/л) || Ag+ (0,1 моль/л )|Ag 26. Fe| Fe+2 (0,005 моль/л ) || Pb+2 (0,005 моль/л )|Pb 27. Ca|Ca+2 (1 моль/л ) || Mg+2 (0,01 моль/л)|Mg 28. Mn|Mn+2 (0,01 моль/л ) || Zn+2 (0,01 моль/л )|Zn 29. Pb|Pb+2 (0,1 моль/л ) ||Cu+2 (0,01 моль/л)|Cu 30. Zn|Zn+2 (10-4 моль/л ) || Sn+2 (10-2 моль/л )|Sn 31. Cd| Cd+2 (10-4 моль/л ) || Cu+2 (10-2 моль/л )|Cu 32. Ni| Ni+2 (0,01 моль/л ) || Ag+ (1 моль/л )|Ag 33. Mg| Mg+2 (0,001 моль/л ) || Mg+2 (1 моль/л )|Mg 34. Ca| Ca+2 (1 моль/л )|| Cr+2 (0,01 моль/л )|Cr 35. Mn|Mn+2 (0,01 моль/л ) || Pb+2 (0,01 моль/л )|Pb 36. Al| Al+3 (2 моль/л ) || Cr+2 (0,01 моль/л )|Cr 37. Be| Be+2 (1 моль/л ) || Sn+2 (0,01 моль/л )|Sn 38. Ni| Ni+2 (1 моль/л )|| Fe+3(2 моль/л )|Fe 39. Pt , h3|H+ (pH=4) || Ag+ (1 моль/л )|Ag 40. Mg| Mg+2 (10-2 моль/л ) || Cu+2 (10-2 моль/л )|Cu 41. Cu| Cu+2 (0,01 моль/л ) || Ag+ (0,1 моль/л )|Ag 42. Ca| Ca+2 (0,01 моль/л ) || Be+2 (1 моль/л )|Be 43. Zn| Zn+2 (0,01 моль/л ) || Ni+2 (1 моль/л )|Ni 44. Al| Al+3 (2 моль/л ) || Fe+2 (0,01 моль/л )|Fe 45. Ca| Ca+2 (1 моль/л ) || Al+3 (0,5 моль/л )|Al 46. Fe| Fe+3 (2 моль/л ) || Cu+2 (0,01 моль/л )|Cu 47. Zn| Zn+2 (1 моль/л ) || Pb+2 (0,01 моль/л )|Pb 48. Sn| Sn+2 (0,01 моль/л ) || Ag+(0,1 моль/л )|Ag 49. Zn| Zn+2 (10-2 моль/л ) || H+(pH=2)|h3,Pt 50. Pt| Sn+4 (0,1 моль/л ),Sn+2 (0,1 моль/л ) || Hg+2 (1 моль/л )|Hg 51. Al| Al+3 (2 моль/л ) || Cd+2 (0,01 моль/л )|Cd 52. Pt|Cr+3(10-2 моль/л ),Cr+2(0,1 моль/л ) || Sn+4 (10-3 моль/л ),Sn+2(0,1 моль/л )|Pt 53. Ni| Ni+2 (0,01 моль/л ) || Pb+2 (0,01 моль/л )|Pb 54. Mg| Mg+2 (10-4 моль/л ) || H+(pH=2)|h3,Pt 55. Cd| Cd+2 (10-2 моль/л ) || Cd+2 (1 моль/л )|Cd 56. Be| Be+2 (10-4 моль/л ) || Zn+2 (10-2 моль/л )|Zn 57. Mn| Mn+2 (1 моль/л ) || Cu+2 (0,1 моль/л)|Cu 58. Ca| Ca+2 (0,01 моль/л ) || Pb+2 (0,01 моль/л )|Pb 59. Sn| Sn+2 (0,01 моль/л ) || Cu+2 (1 моль/л )|Cu 60. Cd| Cd+2 (10-1 моль/л ) || Sn+2 (10-1 моль/л )|Sn 61.Pt|Fe+3(10-2 моль/л ),Fe+2(0,1 моль/л ) || Sn+4(10-2 моль/л ),Sn+2(0,1 моль/л )|Pt 62.Pt|Co+3(10-2 моль/л ), Co+2 (0,1 моль/л ) ||Sn+4 (0,1 моль/л ),Sn+2 (10-2 моль/л )|Pt 63. Pt|Fe+3(0,1 моль/л ), Fe+2(10-2 моль/л ) ||Au+ (10-2 моль/л ), Au+3 (0,1 моль/л )|Pt megaobuchalka.ru Гальваническими элементами называют устройства, в которых энергия окислительно-восстановительных реакций преобразуется непосредственно в электрическую. Методика рассмотрения работы гальванических элементов: · Составляют схему гальванического элемента: (–) Me1 / Me1n + // Me2 m+ / Me2 (+) · По уравнению Нернста находят потенциалы электродов. · Указывают движение электронов во внешней цепи: от электрода с меньшим потенциалом к электроду с более высоким потенциалом. · Записывают уравнения электродных процессов, определяют характер этих процессов. · Составляют суммарное уравнение окислительно-восстановительной реакции, протекающей в гальваническом элементе. · Рассчитывают величину ЭДС гальванического элемента как разность потенциалов положительного и отрицательного электродов. Пример 1. Гальванический элемент с водородным электродом. · Схема Zn / ZnSO4 // h3SO4 , Н2 / Pt. · Электродные потенциалы · Направление движения электронов во внутренней цепи - от цинкового электрода к водородному, так как потенциал цинкового электрода меньше. ē (–) Zn / ZnSO 4 // h3SO4 , Н2 / Pt (+) SO42 - · Уравнения электродных процессов: Zn (-): Zn - 2 ē = Zn 2+- процесс окисления; Pt (+): 2Н ++ 2 ē = Н 2 - процесс восстановления. · Суммарное уравнение: Zn + 2Н + = Zn 2+ + Н 2 Zn + h3SO4 = ZnSO4 + Н 2 · Расчет величины ЭДС: ЭДС = Е0Ox - Е0Red = 0 – (- 0,76) = 0,76 В. Пример 2. Концентрационный гальванический элемент Оба электрода из одного металла, но растворы солей, в которые погружены электроды, разной концентрации. · Схема гальванического элемента: Ni / NiSO 4( Стандартный электродный потенциал · Вычисление электродных потенциалов по уравнению Нернста: · Направление движения электронов по внешней цепи от Ni1 электрода к Ni2, так как ē (-) Ni1 / NiSO4 (10-4 М) // NiSO4 (1 М) / Ni 2 (+) SO42– · Уравнения электродных полуреакций: Ni1 (-): Ni - 2 ē = Ni 2+ - процесс окисления; Ni2 (+): Ni2+ + 2 ē = Ni -процесс восстановления. · Расчет величины ЭДС: ЭДС = Гальванический элемент: схема, принцип работы, применение. Схема гальванический элемент
Принцип работы гальванического элемента
Принцип действия гальванического элемента
Гальванические элементы: преимущества и недостатки
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ. СХЕМА ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА. ТОКООБРАЗУЮЩАЯ РЕАКЦИЯ. ЭДС ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
Гальванические элементы
 1 моль/л,
1 моль/л, 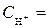 1 моль/л, Т = 298 К, P = 101,3 кПa .
1 моль/л, Т = 298 К, P = 101,3 кПa .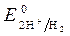 = 0 В ,
= 0 В , 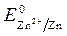 = - 0,76 В (при
= - 0,76 В (при 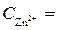 1 моль/л).
1 моль/л).


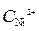 = 10-4 моль/л)// NiSO 4 (
= 10-4 моль/л)// NiSO 4 (  =1моль/л) / Ni
=1моль/л) / Ni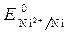 = - 0,25 В.
= - 0,25 В.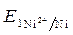 =
= 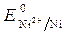 +
+ 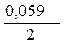 · lg
· lg 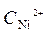 = -0,25 +
= -0,25 + 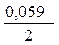 ·lg 10 -4 = -0,309 B.
·lg 10 -4 = -0,309 B.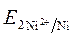 =
=  = - 0,25 B.
= - 0,25 B.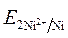 >
> 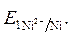


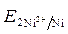 -
- 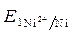 = - 0,25 - (- 0,309) = 0,059 В.
= - 0,25 - (- 0,309) = 0,059 В.Похожие статьи:
poznayka.org
Гальванический элемент: схема, принцип работы, применение
Образование 23 марта 2017Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.

Химические источники тока
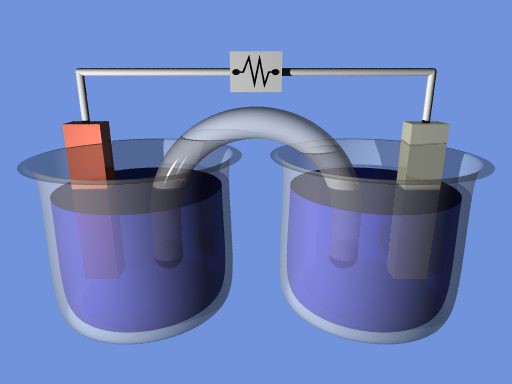
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие катода и анода. Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.
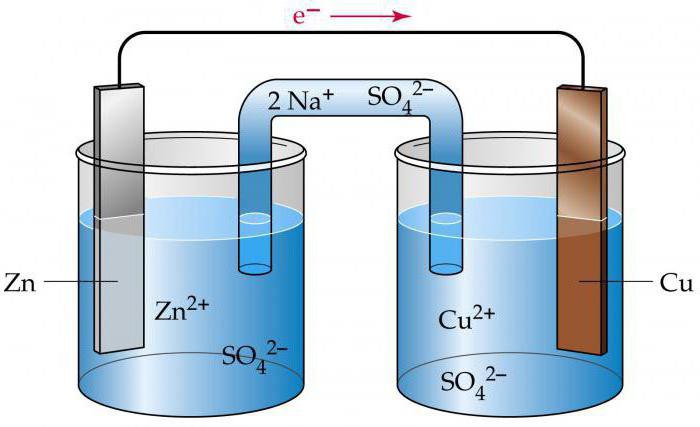
Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде – восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Видео по теме
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя медную пластинку, которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.
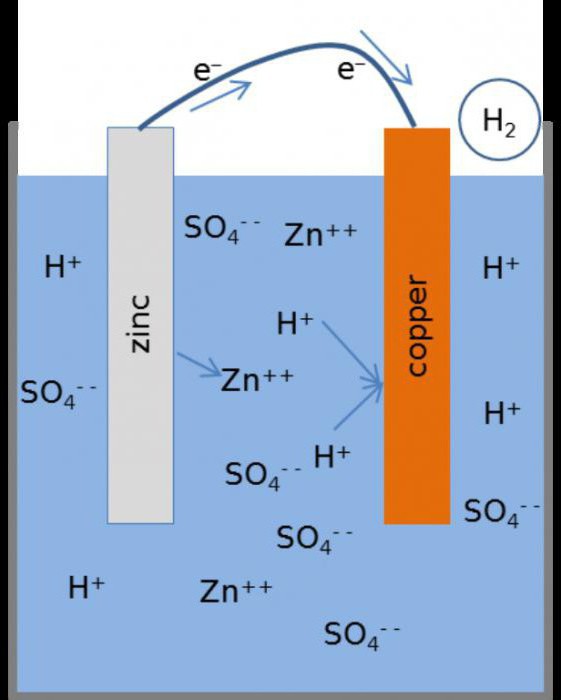
Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Zn = Zn2+ + 2e-
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Cu2+ + 2e- = Cu
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.
Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный электродный потенциал, поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде. В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения. В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
 Технологии Тиристорный регулятор мощности: схема, принцип работы и применение
Технологии Тиристорный регулятор мощности: схема, принцип работы и применениеВ статье рассказывается о том, как работает тиристорный регулятор мощности, схема которого будет представлена нижеВ повседневной жизни очень часто возникает необходимость регулирования мощности бытовых приборов...
 Автомобили Система зажигания. Контактная система зажигания: схема, принцип работы
Автомобили Система зажигания. Контактная система зажигания: схема, принцип работыСистема зажигания двигателя нужна для воспроизводства токов повышенного значения и раздачи его на контактные свечи воспламенения топлива. С учетом изменения оборотов коленчатого вала и нагрузок на мотор импульс высоко...
 Бизнес Лазер твердотельный: принцип работы, применение
Бизнес Лазер твердотельный: принцип работы, применениеДанная статья показывает, какие бывают источники монохроматического излучения и какие преимущества имеет лазер твердотельный перед другими видами. Здесь рассказано, каким образом происходит генерация когерентного излу...
 Бизнес Исполнительный механизм: типы, принцип работы, применение
Бизнес Исполнительный механизм: типы, принцип работы, применениеИсполнительные механизмы применяются в промышленности для управления приводными устройствами. На рынке представлены модификации, которые отличаются между собой по рабочему напряжению и частотности. Схема исполнительно...
 Бизнес Двигатель турбовинтовой: устройство, схема, принцип работы. Производство турбовинтовых двигателей в России
Бизнес Двигатель турбовинтовой: устройство, схема, принцип работы. Производство турбовинтовых двигателей в РоссииДвигатель турбовинтовой похож на поршневый: и тот, и другой имеют воздушный винт. Но во всем остальном они разные. Рассмотрим, что собой представляет этот агрегат, как работает, каковы его плюсы и минусы.Общая...
 Бизнес Синхронный и асинхронный двигатель: отличия, принцип работы, применение
Бизнес Синхронный и асинхронный двигатель: отличия, принцип работы, применениеКлассификация двигателей основывается на разных параметрах. По одному из них, различают синхронный и асинхронный двигатель. Отличия приборов, общая характеристика и принцип работы описаны в статье.Синхронный д...
 Домашний уют "Умный дом": управляющий контроллер. "Умный дом": составляющие элементы, назначение, принцип работы
Домашний уют "Умный дом": управляющий контроллер. "Умный дом": составляющие элементы, назначение, принцип работыКонцепция обустройства «умного дома» давно перешла из разряда фантастических в статус реализуемых. В той или иной мере эта идея воплощается во многих частных коттеджах и квартирах, облегчая эксплуатацию те...
 Домашний уют Мультизональная система кондиционирования: схема, принцип работы, особенности монтажа и отзывы
Домашний уют Мультизональная система кондиционирования: схема, принцип работы, особенности монтажа и отзывыЧто такое мультизональные системы кондиционирования? На самом деле, это устройства для контроля температуры, которые используются в закрытых помещениях. Отличие от обычных сплит-систем кроется в наличие одного блока у...
 Домашний уют Лопастная мешалка: описание, принцип работы, применение в быту и промышленности
Домашний уют Лопастная мешалка: описание, принцип работы, применение в быту и промышленностиМешалки лопастного типа активно применяются в промышленной сфере. Ротор под них чаще всего подбирается двухфазного типа. По мощности устройства сильно отличаются. При выборе модификации важно обращать внимание на мощн...
 Домашний уют Карбюратор - это что? Принцип работы, применение
Домашний уют Карбюратор - это что? Принцип работы, применениеВ этой статье вы узнаете о системах впрыска топлива. Карбюратор – это самый первый механизм, который позволял соединять в нужной пропорции бензин с воздухом для приготовления топливовоздушной смеси и подачи ее в...
monateka.com










Поделиться с друзьями: