№ элемента Химический знак Название элемента Электронная формула 1 H водород 1s1 2 He гелий 1s2 II период 3 Li литий 1s22s1 4 Be бериллий 1s22s2 5 B бор 1s22s22p1 6 C углерод 1s22s22p2 7 N азот 1s22s22p3 8 O кислород 1s22s22p4 9 F фтор 1s22s22p5 10 Ne неон 1s22s22p6 III период 11 Na натрий 1s22s22p63s1 12 Mg магний 1s22s22p63s2 13 Al алюминий 1s22s22p63s23p1 14 Si кремний 1s22s22p63s23p2 15 P фосфор 1s22s22p63s23p3 16 S сера 1s22s22p63s23p4 17 Cl хлор 1s22s22p63s23p5 18 Ar аргон 1s22s22p63s23p6 IV период 19 K калий 1s22s22p63s23p64s1 20 Ca кальций 1s22s22p63s23p64s2 21 Sc скандий 1s22s22p63s23p64s23d1 22 Ti титан 1s22s22p63s23p64s23d2 23 V ванадий 1s22s22p63s23p64s23d3 24 Cr хром 1s22s22p63s23p64s13d5 25 Mn марганец 1s22s22p63s23p64s23d5 26 Fe железо 1s22s22p63s23p64s23d6 27 Co кобальт 1s22s22p63s23p64s23d7 28 Ni никель 1s22s22p63s23p64s23d8 29 Cu медь 1s22s22p63s23p64s13d10 30 Zn цинк 1s22s22p63s23p64s23d10 31 Ga галлий 1s22s22p63s23p64s23d104p1 32 Ge германий 1s22s22p63s23p64s23d104p2 33 As мышьяк 1s22s22p63s23p64s23d104p3 34 Se селен 1s22s22p63s23p64s23d104p4 35 Br бром 1s22s22p63s23p64s23d104p5 36 Kr криптон 1s22s22p63s23p64s23d104p6 V период 37 Rb рубидий 1s 22s 22p 63s 23p64s 23d104p65s1 38 Sr стронций 1s 22s 22p 63s 23p64s 23d104p65s2 39 Y иттрий 1s 22s 22p 63s 23p64s 23d104p65s24d1 40 Zr цирконий 1s 22s 22p 63s 23p64s 23d104p65s24d2 41 Nb ниобий 1s 22s 22p 63s 23p64s 23d104p65s14d4 42 Mo молибден 1s 22s 22p 63s 23p64s 23d104p65s14d5 43 Tc технеций 1s 22s 22p 63s 23p64s 23d104p65s24d5 44 Ru рутений 1s 22s 22p 63s 23p64s 23d104p65s14d7 45 Rh родий 1s 22s 22p 63s 23p64s 23d104p65s14d8 46 Pd палладий 1s 22s 22p 63s 23p64s 23d104p65s04d10 47 Ag серебро 1s 22s 22p 63s 23p64s 23d104p65s14d10 48 Cd кадмий 1s 22s 22p 63s 23p64s 23d104p65s24d10 49 In индий 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 50 Sn олово 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 51 Sb сурьма 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 52 Te теллур 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 53 I йод 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 54 Xe ксенон 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 VI период 55 Cs цезий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 56 Ba барий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 57 La лантан 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 58 Ce церий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 59 Pr празеодим 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 60 Nd неодим 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 61 Pm прометий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 62 Sm самарий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 63 Eu европий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 64 Gd гадолиний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 65 Tb тербий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 66 Dy диспрозий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 67 Ho гольмий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 68 Er эрбий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 68 Tm тулий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 70 Yb иттербий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 71 Lu лютеций 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 72 Hf гафний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 73 Ta тантал 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 74 W вольфрам 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 75 Re рений 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 76 Os осмий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 77 Ir иридий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 78 Pt платина 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 79 Au золото 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 80 Hg ртуть 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 81 Tl таллий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 82 Pb свинец 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 83 Bi висмут 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 84 Po полоний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 85 At астат 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 86 Rn радон 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 VII период 87 Fr франций 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 88 Ra радий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 89 Ac актиний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 90 Th торий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 91 Pa протактиний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 92 U уран 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 93 Np нептуний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 94 Pu плутоний 1s 22s 22p 63s 23p64s 23d104p65s24d10 infotables.ru 5-ege.ru Германий — химический элемент с атомным номером 32 в периодической системе, обозначается символом Ge (Germanium). Элемент был предсказан Д. И. Менделеевым (как эка-кремний) и открыт в 1885 году немецким химиком Клеменсом Винклером при анализе минерала аргиродита Ag8GeS6. Назван в честь Германии, родины Винклера. Общее содержание германия в земной коре 7×10−4% по массе, то есть больше, чем, например, сурьмы, серебра, висмута. Однако собственные минералы германия встречаются исключительно редко. Почти все они представляют собой сульфосоли: германит Cu2(Cu, Fe, Ge, Zn)2 (S, As)4, аргиродит Ag8GeS6, конфильдит Ag8(Sn, Ce) S6 и др. Основная масса германия рассеяна в земной коре в большом числе горных пород и минералов: в сульфидных рудах цветных металлов, в железных рудах, в некоторых окисных минералах (хромите, магнетите, рутиле и др.), в гранитах, диабазах и базальтах. Кроме того, германий присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти. Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °C до простого вещества: Кристаллическая решетка германия кубическая гранецентрированная типа алмаза, параметр а = 5,660 Å . Германий является типичным непрямозонным полупроводником. Легированный галлием германий в тонкой плёнке можно привести в сверхпроводящее состояние. В природе встречается пять изотопов: 70Ge (20,55 % масс.), 72Ge (27,37 %), 73Ge (7,67), 74Ge (36,74 %), 76Ge (7,67 %). Первые четыре стабильны, пятый (76Ge) испытывает двойной бета-распад с периодом полураспада 1,58×1021 лет. Кроме этого существует два «долгоживущих» искусственных: 68Ge (время полураспада 270,8 дня) и 71Ge (время полураспада 11,26 дня). В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода. Применение находят сплавы германия и стёкла на основе диоксида германия. Средние цены на германий в 2007 году /по материалам infogeo.ru/metalls www.himsnab-spb.ru Материал из свободной русской энциклопедии «Традиция» а. е. м. (г/моль) Герма́ний — химический элемент с атомным номером 32 в периодической системе, обозначается символом Ge (нем. Germanium). Элемент был предсказан великим русским учёным Д. И. Менделеевым (как эка-кремний) и открыт в 1885 году немецким химиком Клеменсом Винклером при анализе минерала аргиродита Ag8GeS6. Химический элемент Германий назван в честь Германии, родины Винклера. Общее содержание Германия в земной коре 7% по массе, то есть больше, чем, например, сурьмы, серебра, висмута. Однако собственные минералы Германия встречаются исключительно редко. Почти все они представляют собой сульфосоли: германит Cu2(Cu, Fe, Ge, Zn)2 (S, As)4, аргиродит Ag8GeS6, конфильдит Ag8(Sn, Ce) S6 и др. Основная масса Г. рассеяна в земной коре в большом числе горных пород и минералов: в сульфидных рудах цветных металлов, в железных рудах, в некоторых окисных минералах (хромите, магнетите, рутиле и др.), в гранитах, диабазах и базальтах. Кроме того, Г. присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти.[1] Германий встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2,который восстанавливают водородом при 600 °C до простого вещества: GeO2+2h3=Ge+2h3O. Кристаллическая решётка германия кубическая гранецентрированная по типу алмаза, параметр а = 5,660 Å. Германий как и кремний отличается ценными оптическими характеристиками — способность пропускать ИК-лучи. Важно, обладая низкой дисперсией, высокой прозрачностью и коэффициентом преломления n=1,7 (кремний n=3,4) в композициях шихты с кремнием в разных соотнешениях позволяют изготакливать линзы с нужным показателем преломления.(линзы анастигматов и зумов изготавливают в первую очередь с подбором характериситк по показетелю преломления). Линзы, (объективы) прозрачных для (пропускающих) ИК-лучей при изготовлении применяют в качестве основных оптических материалов как кремний, германий . Германий является типичным непрямозонным полупроводником. В природе встречается пять изотопов: 70Ge (20,55% масс.), 72Ge (27,37%), 73Ge (7,67), 74Ge (36,74%), 76Ge (7,67%). Первые четыре стабильны, пятый (76Ge) испытывает двойной бета-распад с периодом полураспада 1,58×1021 лет. Кроме этого существует два «долгоживущих» искусственных: 68Ge (время полураспада 270,8 дня) и 71Ge (время полураспада 11,26 дня). В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода. Применение находят сплавы германия и стёкла на основе диоксида германия. Теллурид германия издавна применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо-ЭДС 50 мкВ/К). Германий широко применяется в ядерной энергетике в качестве материала для детекторов гамма-излучения. В радиотехнике, германиевые транзисторы и детекторные диоды обладают характеристиками, отличными от кремниевых, ввиду меньшего напряжения отпирания pn-перехода в германии - 0.4В против 0.6В у кремниевых приборов. В своё время германиевые полупроводниковые приборы использовались повсеместно в радиоприёмниках и других конструкциях. Например, схема JOULE[8] (в отечественной радиотехнике известная как блокинг-генератор) позволяет питать трёхвольтовый светодиод от 0,6 В, если в ней применён кремниевый транзистор, и начиная всего с 0,125 В, если германиевый. HI-End усилители на германиевых транзисторах обладают качеством звука, сопоставимым с усилителями на радиолампах, т.к. германиевые транзисторы мягче переключатся в схемах усилителя класса "AB", имеют более линейную переходную характеристику (чем сопоставимые кремниевые транзисторы тех же лет выпуска), и не пропускают гармоники дальше пятой (тогда как кремниевые - до 11-той - из-за чего звук становится "жестким" на высоких частотах). В классификации радиоэлектроники по советскому ГОСТу кремниевые полупроводниковые элементы обозначались, начиная с буквы К или с цифры 2, а германиевые с буквы Г или цифры 1, например: ГТ313, 1Т308 — германиевые высокочастотные маломощные транзисторы. Существует старая система обозначений, например, П210,213,214,217, и некоторые транзисторы "МПxx" - также германиевые. Ещё более высоким частотным потенциалом (имеется ввиду подвижность носителей заряда в полупроводниках, а не скорость работы готового полупропроводникового прибора) обладает арсенид галлия, применяемый в светодиодах. В настоящее время германиевые диоды и транзисторы полностью вытеснены кремниевыми и не выпускаются ни в одной стране мира. Найти их можно только в старых радиоаппаратах либо из запасов радиолюбителей тех лет. Теллурид германия издавна применяется как стабильный термоэлектрический материал и компонент термоэлектрических сплавов (термо-ЭДС 50 мкВ/К). Диоксид германия также используется как катализатор в производстве смолы терефталата полиэтилена,[9] и для производства других примесей или химсоединений германия. Для медицинских нужд германий первыми начали применять в Японии. Испытания различных германийорганических соединений в опытах на животных и в клинических испытаниях на людях показали, что они в разной степени положительно влияют на организм человека. В 1967 г. доктор К. Асаи обнаружил, что органический германий, способ синтеза которого был ранее разработан в нашей стране, обладает широким спектром биологического действия. Биологические свойства органического германия: Японскими учеными был создан первый препарат с содержанием органического германия «Германий–132», который используется для коррекции иммунного статуса при различных заболеваниях человека. В России, как обычно, биологическое действие германия изучалось давно, но создание первого российского препарата «Гермавит» стало возможным только в 2000 г., когда финансы в развитие науки и, в частности, медицины стали вкладывать российские бизнесмены, понимающие, что здоровье нации требует самого пристального внимания, а его укрепление без должного финансирования — это разговоры, не решающие важнейшей социальной задачи нашего времени. traditio.wiki Cтраница 4 Атомом индия замещен один атом германия. При этом оказываются заполненными электронные связи лишь трех соседних атомов, а связь с одним из четырех атомов германия будет. [46] В упомянутых выше реакциях атом германия вводится в конец углеродной цепи. [47] Пусть на один миллион атомов германия приходится всего один атом мышьяка. В таком полупроводнике преобладает электронная проводимость. [48] При отрыве электронов от атомов германия в последних образуются свободные места, которые могут быть заняты другими электронами. [50] Пусть на один миллион атомов германия приходится всего один атом мышьяка. В таком полупроводнике преобладает электронная проводимость. [52] В обеих модификациях вокруг атома германия тетраэдрически расположены четыре атома азота, и каждый атом азота, по-видимому, окружен тремя атомами герма ия. [53] По-видимому, 17 % атомов германия, находящихся в тетраэдрическом окружении, могут быть замещены на фосфор. [54] При отрыве от анода атома германия необходимо разорвать две ковалентные связи. [55] Пусть на один миллион атомов германия приходится всего один атом мышьяка. В таком полупроводнике преобладает электронная проводимость. [57] Рассматривая структуру электронных оболочек атома германия, следует сделать вывод о том, что в А - оболочке атома германия для ее достройки до оболочки криптона недостает четырех электронов. [58] По-видимому, 17 % атомов германия, находящихся в тетраэдрическом окружении, могут быть замещены на фосфор. [59] Если же один из атомов германия заменить атомом акцепторной примеси, например трехвалентным индием In ( рис. 211, б), то в силу структуры решетки германия атом индия захватит еще один электрон из заполненной зоны и превратится в отрицательный ион, а в заполненной зоне появится дырка. [60] Страницы: 1 2 3 4 5 www.ngpedia.ru Определите тип химической связи (неполярная ковалентная, полярная ковалентная или ионная) в веществах тетрабромид германия и трифторид азота. В случае полярной или ионной связи укажите направление смещения электронов. В случае ковалентной (полярной или неполярной) связи постройте электронные схемы молекул (теория Льюиса) и определите кратность связи, постройте схемы перекрывания электронных орбиталей (метод ВС) и определите геометрическую форму молекулы. Электроотрицательность (EN) характеризует способность атомов элементов к смещению электронной плотности. В периоде системы элементов Д. И. Менделеева она возрастает слева направо, в подгруппе убывает сверху вниз (для s- и p-элементов). Тип химической связи (неполярная ковалентная, полярная ковалентная или ионная), образующейся в результате взаимодействия атомов А и В, можно установить по величине разности электроотрицательностей EN этих атомов: - если она равна (или близка к) нулю, то электронная плотность распределена симметрично между атомами, химическая связь является неполярной ковалентной; такая связь наиболее характерна для молекул, образованных атомами одного и того же элемента. - если она не равна нулю, но невелика (взаимодействуют атомы элементов-неметаллов), химическая связь относится к типу полярной ковалентной; при этом электронная плотность смещается от менее электроотрицательного атома А (положительный полюс А+ ) к более электроотрицательному В (отрицательный полюс В- ). - если она крайне велика (во взаимодействие вступают атом элементаА-типичного металла и атом элемента В-типичного неметалла), происходит передача электронов от менее электроотрицательного атома (он превращается в положительно заряженный ион Аm+) к более электроотрицательному атому ( он превращается в отрицательно заряженный ион Вn-). Процесс передачи электронов можно отобразить с помощью уравнений: A0 - m e = Am+ В0 + n e = Вn- Электростатическое притяжение между разноименно заряженных ионов называют ионной связью.Для рассматриваемых в задаче веществ: разность электроотрицательностей атомов элементов брома и германия различна разность электроотрицательностей атомов элементов фтора и азота различна поэтому типы химической связи: в этих веществах: полярная ковалентная полярная ковалентная В случае ковалентной связи необходимо представить электронную схему молекулы (теория Льюиса) и схему перекрывания электронных орбиталей (метод ВС). Согласно простейшим представлениям о механизме образования ковалентной связи (теория Льюиса), атомы обобщают свои валентные электроны, достраивая свою электронную оболочку до октета (8 электронов) – конфигурации благородных газов. Исключение составляет атом водорода, способный достроить свою электронную оболочку лишь до двух электронов (электронная конфигурация атома гелия). Электронная схема молекулы показывает, сколько электронов обобщают атомы, при этом электрон изображается точкой. Число общих электронных пар между двумя атомами определяет кратность ковалентной связи: одна пара - одинарная, две пары - двойная, три пары - тройная. Для построения электронной схемы необходимо: определить общее число валентных электронов каждого атома по номеру группы в периодической системе Д.И. Менделеева, выяснить, сколько электронов не достает каждому из них до октета, построить схему обобщения, изображая электроны в виде точек Электронная схема молекулы тетрабромида германия, в состав которой входит атом элемента Br (7 группа периодической системы Д.И. Менделеева), имеющий 7валентных электронов, и атом элемента Ge, представителя группы N 4, имеющий 4 валентных электронов, выглядит следующим образом: Поскольку в результате обобщения электронов между каждой парой атомов образовалось 1 общих электронных пар, то кратность данной ковалентной связи в молекуле GeBr4 равна 1. Электронная схема молекулы трифторида азота, в состав которой входит атом элемента F (7 группа периодической системы Д.И. Менделеева), имеющий 7 валентных электронов, и атом элемента N, представителя группы N 5, имеющий 5 валентных электронов, выглядит следующим образом: Поскольку в результате обобщения электронов между каждой парой атомов образовалось 1 общая электронная пара, то кратность данной ковалентной связи в молекуле NF3 равна 1. Одна из квантово-механических интерпретаций механизма образования ковалентной связи - метод ВС - предусматривает изображение схемы перекрывания орбиталей, соответствующих одиночным (неспаренным) валентным электронам каждого из атомов. Для построения данной схемы необходимо: - составить электронные формулы атомов, образующих данную молекулу: -выбрать валентные электроны (электроны внешнего, последнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен неполностью): -распределить эти электроны по квантовым ячейкам (таким образом, чтобы наибольшее число ячеек было занято электронами), символизируя электрон со значением спинового квантового числа стрелкой, направленной вверх а электрон с ms = -1/2 стрелкой, направленной вниз . найти одиночные (неспаренные) валентные электроны и определить орбитали, которые им соответствуют; нарисовать схему перекрывания орбиталей. Если неспаренные валентные электроны атома занимают разные подуровни, то в образовании ковалентной связи участвуют не «чистые» s- и p-орбитали, а их гибриды. Гибридные орбитали образуются в результате геометрического сложения обычных орбиталей (сферической s–орбитали и симметричной гантелеобразной р-орбитали) и представляют собой усредненные по форме орбитали (несимметричная гантелеобразная орбиталь, одна из лопастей которой увеличена по сравнению с исходной, а другая уменьшена по сравнению с исходной). Число гибридных орбиталей равно числу исходных s– и р-орбиталей. Тип гибрида (sp, sp2, sp3) указывает число и вид исходных орбиталей. Взаимное расположение гибридных орбиталей в пространстве должно обеспечивать максимальную симметрию: Исходные орбитали тип гибрида Число Гибридных орбиталей Геометрическая форма молекулы Sp две линейная Sp2 три равносторонний треугольник Sp3 четыре тетраэдр Ge 1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p2 3d-подуровень 4p-подуровень Геометрическая форма – тетраэдр, тип гибридизации sp3 Br 1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p5 4s-подуровень 4p- подуровень 1. схема перекрывания орбиталeй для молекулы трифторид азота F 1s2-2s5 N 1s2-2s3 F 1s-подуровень 2s-подуровень N 1s-подуровень 2s-подуровень 2p-подуровень F p ↔ p N F p ↔ p F p ↔ p Геометрическая форма молекулы: пирамида studfiles.net Электронные формулы, обозначения и русские наименования атомов химических элементов. Слои показаны - в порядке заполнения подуровней. tehtab.ruЭлектронные формулы атомов химических элементов (Таблица). Электронная схема германия
Электронные формулы атомов химических элементов (Таблица)
Электронные формулы атомов химических элементов (109)
№ эл-та Химическийзнак Названиеэлемента Электронная формула 1 H водород 1s 1 2 He гелий 1s 2 II период 3 Li литий 1s 22s 1 4 Be бериллий 1s 22s 2 5 B бор 1s 22s 22p 1 6 C углерод 1s 22s 22p 2 7 N азот 1s 22s 22p 3 8 O кислород 1s 22s 22p 4 9 F фтор 1s 22s 22p 5 10 Ne неон 1s 22s 22p 6 III период 11 Na натрий 1s 22s 22p 63s 1 12 Mg магний 1s 22s 22p 63s 2 13 Al алюминий 1s 22s 22p 63s 23p1 14 Si кремний 1s 22s 22p 63s 23p2 15 P фосфор 1s 22s 22p 63s 23p3 16 S сера 1s 22s 22p 63s 23p4 17 Cl хлор 1s 22s 22p 63s 23p5 18 Ar аргон 1s 22s 22p 63s 23p6 IV период 19 K калий 1s 22s 22p 63s 23p64s 1 20 Ca кальций 1s 22s 22p 63s 23p64s 2 21 Sc скандий 1s 22s 22p 63s 23p64s 23d1 22 Ti титан 1s 22s 22p 63s 23p64s 23d2 23 V ванадий 1s 22s 22p 63s 23p64s 23d3 24 Cr хром 1s 22s 22p 63s 23p64s 13d5 25 Mn марганец 1s 22s 22p 63s 23p64s 23d5 26 Fe железо 1s 22s 22p 63s 23p64s 23d6 27 Co кобальт 1s 22s 22p 63s 23p64s 23d7 28 Ni никель 1s 22s 22p 63s 23p64s 23d8 29 Cu медь 1s 22s 22p 63s 23p64s 13d10 30 Zn цинк 1s 22s 22p 63s 23p64s 23d10 31 Ga галлий 1s 22s 22p 63s 23p64s 23d104p1 32 Ge германий 1s 22s 22p 63s 23p64s 23d104p2 33 As мышьяк 1s 22s 22p 63s 23p64s 23d104p3 34 Se селен 1s 22s 22p 63s 23p64s 23d104p4 35 Br бром 1s 22s 22p 63s 23p64s 23d104p5 36 Kr криптон 1s 22s 22p 63s 23p64s 23d104p6 V период 37 Rb рубидий 1s 22s 22p 63s 23p64s 23d104p65s1 38 Sr стронций 1s 22s 22p 63s 23p64s 23d104p65s2 39 Y иттрий 1s 22s 22p 63s 23p64s 23d104p65s24d1 40 Zr цирконий 1s 22s 22p 63s 23p64s 23d104p65s24d2 41 Nb ниобий 1s 22s 22p 63s 23p64s 23d104p65s14d4 42 Mo молибден 1s 22s 22p 63s 23p64s 23d104p65s14d5 43 Tc технеций 1s 22s 22p 63s 23p64s 23d104p65s24d5 44 Ru рутений 1s 22s 22p 63s 23p64s 23d104p65s14d7 45 Rh родий 1s 22s 22p 63s 23p64s 23d104p65s14d8 46 Pd палладий 1s 22s 22p 63s 23p64s 23d104p65s04d10 47 Ag серебро 1s 22s 22p 63s 23p64s 23d104p65s14d10 48 Cd кадмий 1s 22s 22p 63s 23p64s 23d104p65s24d10 49 In индий 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 50 Sn олово 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 51 Sb сурьма 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 52 Te теллур 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 53 I йод 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 54 Xe ксенон 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 VI период 55 Cs цезий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 56 Ba барий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 57 La лантан 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 58 Ce церий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 59 Pr празеодим 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 60 Nd неодим 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 61 Pm прометий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 62 Sm самарий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 63 Eu европий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 64 Gd гадолиний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 65 Tb тербий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 66 Dy диспрозий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 67 Ho гольмий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 68 Er эрбий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 68 Tm тулий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 70 Yb иттербий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 71 Lu лютеций 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 72 Hf гафний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 73 Ta тантал 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 74 W вольфрам 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 75 Re рений 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 76 Os осмий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 77 Ir иридий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 78 Pt платина 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 79 Au золото 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 80 Hg ртуть 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 81 Tl таллий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 82 Pb свинец 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 83 Bi висмут 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 84 Po полоний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 85 At астат 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 86 Rn радон 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 VII период 87 Fr франций 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 88 Ra радий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 89 Ac актиний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 90 Th торий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 91 Pa протактиний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 92 U уран 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 93 Np нептуний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 94 Pu плутоний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 95 Am америций 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 96 Cm кюрий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 97 Bk берклий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 98 Cf калифорний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 99 Es эйнштейний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 100 Fm фермий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 101 Md менделеевий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 102 No нобелий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 103 Lr лоуренсий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 104 Rf резерфордий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 105 Db дубний 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 106 Sg сиборгий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 107 Bh борий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 108 Hs хассий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 109 Mt мейтнерий 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 Обозначения элементов: s-элементы p-элементы d-элементы f-элементы Германий
Германий Атомный номер 32 Внешний вид простого вещества Кристалл германия — светло-серый полупроводник с металлическим блеском Свойства атома Атомная масса(молярная масса) 72,61 а. е. м. (г/моль) Радиус атома 137 пм Энергия ионизации(первый электрон) 760,0 (7,88) кДж/моль (эВ) Электронная конфигурация [Ar] 3d10 4s2 4p2 Химические свойства Ковалентный радиус 122 пм Радиус иона (+4e) 53 (+2e) 73 пм Электроотрицательность(по Полингу) 2,01 Электродный потенциал 0 Степени окисления 4 Термодинамические свойства простого вещества Плотность 5,323 г/см³ Молярная теплоёмкость 23,32[1]Дж/(K·моль) Теплопроводность 60,2 Вт/(м·K) Температура плавления 1210,6 K Теплота плавления 36,8 кДж/моль Температура кипения 3103 K Теплота испарения 328 кДж/моль Молярный объём 13,6 см³/моль Кристаллическая решётка простого вещества Структура решётки алмазная Параметры решётки 5,660 Å Отношение c/a — Температура Дебая 360 K Ge 32 72,61 4s24p2 Германий История
Схема атома германияПроисхождение названия
Нахождение в природе
Получение
Физические свойства
Кристаллическая структура германия.Механические свойства
Электронные свойства
Изотопы
Химические свойства
Соединения германия
Неорганические
Органические
Применение
Германий — Традиция
Германий (Ge) 
Свойства атома Атомная масса(молярная масса) 72,61 а. е. м. (г/моль) Радиус атома 137 пм Энергия ионизации(первый электрон) 760,0(7,88)кДж/моль(эВ) Электронная конфигурация [Ar] 3d10 4s2 4p2 Химические свойства Ковалентный радиус 122 пм Радиус иона (+4e)53(+2e)73пм Электроотрицательность(по Полингу) 2,01 Электродный потенциал — Степени окисления 4 Термодинамические свойства простого вещества Плотность 5,323 г/см³ Удельная теплоёмкость 0,322 Дж/(K·моль) Теплопроводность 60.2 Вт/(м·K) Температура плавления 1210 K) Теплота плавления 36,8 кДж/моль Температура кипения 3103 K Теплота испарения n/a кДж/моль Молярный объём 13,6 см³/моль Кристаллическая решётка простого вещества Структура решётки алмаз Период решётки 5,660 Å Отношение c/a n/a Температура Дебая 360,00 K 
Месторасположение[править]
Физические свойства[править]
Кристаллическая структура германия Механические свойства[править]
Электронные свойства[править]
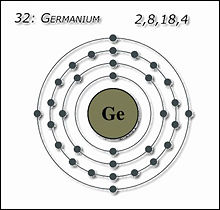 Схема атома Германия
Схема атома Германия Изотопы[править]
Химические свойства[править]
Соединения германия[править]
Неорганические[править]
Органические[править]
Металлургия[править]
Ядерная энергетика[править]
Электроника и радиотехника[править]
Медицина[править]
Оптическое стекло[править]
![]() Основная статья:
Основная статья: Атом - германий - Большая Энциклопедия Нефти и Газа, статья, страница 4
Атом - германий
Задача n 50
Решение:
Электронные формулы, обозначения и русские наименования атомов химических элементов.
55
Cs
цезий
Cs - [Xe] 6s 1
Cs - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 1
56
Ba
барий
Ba - [Xe] 6s 2
Ba - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 6s 2
57
La
лантан
La - [Xe] 5d 1 6s 2
La - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 5d 1 6s 2
58
Ce
церий
Ce - [Xe] 5d 1 6s 2
Ce - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 5d 1 6s 2
59
Pr
празеодим
Pr - [Xe] 4f 3 6s 2
Pr - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 3 6s 2
60
Nd
неодим
Nd - [Xe] 4f 4 6s 2
Nd - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 4 6s 2
61
Pm
прометий
Pm - [Xe] 4f 5 6s 2
Pm - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 5 6s 2
62
Sm
самарий
Sm - [Xe] 4f 6 6s 2
Sm - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 6 6s 2
63
Eu
европий
Eu - [Xe] 4f 7 6s 2
Eu - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 7 6s 2
64
Gd
гадолиний
Gd - [Xe] 4f 7 5d 1 6s 2
Gd - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 7 5d 1 6s 2
65
Tb
тербий
Tb - [Xe]4f 9 6s 2
Tb - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 9 6s 2
66
Dy
диспрозий
Dy - [Xe] 4f 10 6s 2
Dy - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 10 6s 2
67
Ho
гольмий
Ho - [Xe] 4f 11 6s 2
Ho - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 11 6s 2
68
Er
эрбий
Er - [Xe] 4f 12 6s 2
Er - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 12 6s 2
68
Tm
тулий
Tm - [Xe] 4f 13 6s 2
Tm - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 13 6s 2
70
Yb
иттербий
Yb - [Xe] 4f 14 6s 2
Yb - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 6s 2
71
Lu
лютеций
Lu - [Xe] 4f 14 5d 1 6s 2
Lu - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 1 6s 2
72
Hf
гафний
Hf - [Xe] 4f 14 5d 2 6s 2
Hf - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 2 6s 2
73
Ta
тантал
Ta - [Xe] 4f 14 5d 3 6s 2
Ta - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 3 6s 2
74
W
вольфрам
W - [Xe] 4f 14 5d 4 6s 2
W - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 4 6s 2
75
Re
рений
Re - [Xe] 4f 14 5d 5 6s 2
Re - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 5 6s 2
76
Os
осмий
Os - [Xe] 4f 14 5d 6 6s 2
Os - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 6 6s 2
77
Ir
иридий
Ir - [Xe] 4f 14 5d 7 6s 2
Ir - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 7 6s 2
78
Pt
платина
Pt - [Xe] 4f 14 5d 9 6s 1
Pt - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 9 6s 1
79
Au
золото
Au - [Xe] 4f 14 5d 10 6s 1
Au - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 1
80
Hg
ртуть
Hg - [Xe] 4f 14 5d 10 6s 2
Hg - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2
81
Tl
таллий
Tl - [Xe] 4f 14 5d 10 6s 2 6p 1
Tl - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 64f 14 5d 10 6s 2 6p 1
82
Pb
свинец
Pb - [Xe] 4f 14 5d 10 6s 2 6p 2
Pb - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 2
83
Bi
висмут
Bi - [Xe] 4f 14 5d 10 6s 2 6p 3
Bi - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 3
84
Po
полоний
Po - [Xe] 4f 14 5d 10 6s 2 6p 4
Po - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 64f 14 5d 10 6s 2 6p 4
85
At
астат
At - [Xe] 4f 14 5d 10 6s 2 6p 5
At - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 5
86
Rn
радон
Rn - [Xe] 4f 14 5d 10 6s 2 6p 6
Rn - 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 5s 2 4d 10 5p 6 4f 14 5d 10 6s 2 6p 6
интернет-магазин светодиодного освещения
Пн - Вс с 10:30 до 20:00
Санкт-Петербург, просп. Энгельса, 138, корп. 1, тк ''Стройдвор''









Поделиться с друзьями: