Привет, вот так нужноа) Молекула оксида углерода. Строение электронных оболочек атомов углерода и кислорода: class.rambler.ru а) Молекула оксида углерода. Строение электронных оболочек атомов углерода и кислорода: В молекуле оксида углерода две связи образованы за счет двух неспаренных электронов атома углерода и двух неспаренных электронов атома кислорода. У атома кислорода есть еще пара электронов на 2р-орбитали, а у атома углерода – свободная 2р-орбиталь. Пара электронов переходит от атома кислорода к атому углерода, образуют донорно-акцепторную связь. Электронную формулу оксида углерода (II) можно изобразить так: (стрелочкой обозначена донорно-акцепторная связь). б) Молекула азотной кислоты. Электронные схемы атомов водорода, кислорода и азота: Атом водорода образует за счет единственного электрона связь с атомом кислорода. Второй электрон атома кислорода участвует в образовании связи с атомом азота: У атома азота остается два неспаренных электрона, и он образует две связи со вторым атомом кислорода: У атома азота осталась еще электронная пара на 2s-орбитали. В третьем атоме кислорода происходит спаривание электронов, и образуется свободная орбиталь: Пара электронов от атома азота переходит на освободившуюся орбиталь атома кислорода и образуется донорно-акцепторная связь: 5terka.com В области фазовых переходов (плавление, кристаллизация) также наблюдается резкое изменение теплоемкости полимеров. Эти процессы обычно изучаются методами адиабатной калориметрии (точность которой в результате применения электронных схем является достаточно высокой) в широком интервале температур. На температурных зависимостях теплоемкостей полимеров [10.6] проявляются характерные пики (рис. 10.17), которые с увеличением скорости нагревания сдвигаются в сторону повышенных температур (при этом высота их увеличивается). Такой характер изменения теплофизических свойств при переходе поливинилацетата (ПВА) из твердого состояния в жидкое обусловлен релаксационной природой процесса размягчения и связан с тепловой предысторией образцов. Так как температура стеклования ПВА равна 35° С, выдержка его при комнатной температуре равносильна хорошему отжигу. [c.267] В дальнейшем на электронных схемах мы для упрощения будем указывать только неполностью занятые энергетические уровни, В соответствии с э 1им, строение электронной оболочки атома еле дующего элемента второго периода — бериллия (2 = 4)—выра жается схемой [c.89] В настоящее время продукты каталитического и термического крекингов чистых углеводородов изучены достаточно хорошо, что позволяет дать детальную характеристику этих процессов. По-ясно наблюдаемой разнице в составе продуктов можно установить наличие двух типов разрыва углерод-углеродной связи. Как будет показано ниже, для каталитического крекинга типичным является ионное (с участием иона карбония) гетеро-литическое расщепление связи С—С, что выражается следующей электронной схемой [c.114] Высокую разрешающую способность (наименьшая А21/2) можно получить, повышая так называемую четкость сигнала. При регистрации сигналов, имеющих форму кривой Лоренца или Гаусса, полуширину можно уменьшить, е .ли вместо основной функции записывать ее вторую производную, осуществляя двукратное дифференцирование при помощи электронной схемы (рис. Д. 192). Для функции Лоренца отношение полуширины Д21/2 основной функции и ее второй производной составляет 1/(1/3), а для функции Гаусса — 1/(1/2). При получении второй производной Л2]/2 уменьшается, таким образом, на 1/3 или на 1/2 соответственно. Теоретически допустимо усиливать четкость сигнала, получая производные более высокого порядка с одновременным увеличением интенсивности сигналов. [c.450] Большинство современных теорий нелинейных систем автоматического регулирования основано на весьма старой теории анализа нелинейных механизмов и нелинейных электронных схем или непосредственно вытекает из нее . Хотя работы в этом направлении ведутся в течение 40 лет, наши знания о нелинейных системах значительно уступают сведениям о линейных системах. Причина этого состоит в отсутствии общих методов решения, таких, как, например, методы частного анализа линейных систем. [c.106] Электронные схемы управления [c.151] Силоксановые герметики и компаунды применяются для герметизации штепсельных разъемов, электрических машин, электронных схем и приборов с целью их защиты от пыли, вибрации, атмосферных и иных воздействий. Заливка ими электродвигателей и трансформаторов обеспечивает длительную эксплуатацию последних в жестких условиях, в том числе под водой. Заливка электронных схем прозрачными компаунда.ми обеспечивает, кроме того, контроль за их состоянием и возможность ремонта. [c.497] Описанное явление называют поляризацией ионов. Способность иона к поляризации характеризуется величиной, называемой поляризуемостью иона последняя бывает тем больше, чем менее прочно связаны электроны с атомом. Поэтому более высокой она оказывается у отрицательных ионов (С1 , Вг, О и др.), а более слабой — у положительных ионов (Na+, К" , a + и других), что легко видеть, сопоставляя электронные схемы, показанные на рис. 11. [c.62] Для нормальной работы трехкомпонентного нейтрализатора необходима обратная связь между качеством отработавших газов и системой питания двигателя. Такая связь должна поддерживать уровень расхода воздуха примерно 14,6 кг на 1 кг сожженного бензина. При богатой смеси (анеполнота сгорания, а при бедной смеси (а>1,0), как сказано выше, возможно образование аммиака с появлением резкого запаха отработавших газов. Эту связь обеспечивает электронная схема регулирования с помощью так называемого кислородного датчика, измеряющего мгновенное содержание свободного кислорода в отработавших газах. Датчик монтируется на корпусе нейтрализатора и имеет слой оксида циркония или титана, покрытого платиной (датчик Ъ>). Такая электрохимическая ячейка реагирует на атомы кислорода и создает разность потенциалов до одного вольта. Эта разность потенциалов и служит управляющим сигналом, заставляющим электронный модуль изменять подачу топлива в двигатель до тех пор, пока в отработавших газах не останется свободного, то есть не вступившего в химическую реакцию, кислорода. Таким образом, автоматически поддерживается стехиометрический состав рабочей смеси во всех диапазонах нагрузок и частот вращения коленчатого вала двигателя. Такие трехкомпонентные нейтрализаторы при соответствующем финансировании могут производиться в России в количестве, необходимом для оснащения всех выпускаемых в стране автомобилей. [c.337] Составить. электронные схемы и закончить составление следующих уравнений [c.149] Закончить составление следующих уравнений и составить электронные схемы [c.150] Напишем электронную схему реакции аммиака с хлористым водородом [c.251] При пересчете показателя надежности прототипа на условия применения проектируемого объекта находят коэффициент условий применения, равный отношению показателей надежности рассматриваемого объекта и прототипа. Такой пересчет можно осуществить, используя различные методы, разработанные для расчета надежности проектируемых электронных схем [10]. [c.41] Установки с воздушными подвесами по сравнению с установками для определения неуравновешенности в динамическом режиме очень просты и надежны в эксплуатации, значительно меньше потребляют электроэнергии и сжатого воздуха, занимают в 2 раза меньшую производственную площадь. При одинаковой точности определения неуравновешенности не требуется измерительных электронных схем, привода для разгона ротора. [c.90] Станки на электронной схеме работают при постоянном (для данного типа станка) числе оборотов, независимо от массы ротора специальное устройство позволяет после выхода на номинальное число оборотов определить массу и угол установки уравнивающего груза. [c.106] Типовой технологический процесс динамической балансировки на станках с электронной схемой состоит из следующих операций [c.108] Ввиду важности количественной характеристики качества псевдоожижения — параметра б, как для исследований структуры кипящего слоя, так и для ее регулирования в производственных условиях, необходимо было автоматизировать процесс ее измерения. Простейшим и наиболее удобным в лабораторных условиях явилась непосредственная подача вырабатываемого емкостным зондом переменного напряжения U (), пропорционального плотности р (/), в интегрирующие блоки аналоговой ЭВМ. Использованная нами схема такой системы, содержащей фильтр верхних частот, набранный на операционных усилителях ЭВМ, приведена в [1 ]. Разработанные в дальнейшем различными группами исследователей [108] электронные схемы с применением аналоговых или цифровых ЭВМ или в виде специально сконструированных приборов, позволяют в настоящее время измерять значения р и б практически непрерывно и использовать этот метод для контроля и автоматического регулирования качества псевдоожижения. [c.88] История развития электронной вычислительной техники охватывает относительно короткий период времени. Первая вычислительная машина, в которой для выполнения арифметических и логических операций использовались электронные схемы, появилась в 1945 г. Однако за этот период электронная вычислительная техника совершила большой скачок. В настояш,ее время в ее развитии принято выделять следующие три этапа (три поколения ЦВМ). [c.50] На электронных схемах пара электронов, находящаяся на общей молекулярной орбите, т. е. образующая химическую связь, изо- [c.11] В некоторых случаях на электронных схемах изображают не все электроны, находящиеся на внешних оболочках, а лишь [c.11] До 1950 г. основное внимание в работах по масс-спектро-метрии уделялось конструированию приборов, особенно ионных источников [4]. Для регистрации малых ионных токов были созданы соответствующие электронные лампы и усилители постоянного тока [5]. Применение электронных схем питания электромагнита и ускоряющего напряжения и конструирование удобных регистрирующих приборов привели к созданию масс-спектрометра с автоматизацией всех основных узлов [6]. Были также решены проблемы напуска газов и летучих соединений. К 1950 г. была в основном решена проблема создания хорошего и быстрого метода расчета результатом. [c.7] Такими частицами являются свободные атомы ряда элементов, например, Н, N. О, атомы галогенов, атомы щелочных металлов. Эти атомы имеют один неспаренный 5-электрон (атом Н и атомы щелочных металлов) или р-электрон (атомы галогенов), или несколько неспаренных р-электронов — два (атом О) или три (атом Н) (см. электронные схемы на стр. 10). [c.15] Были внесены изменения в оптическую и электронные схемы прибора, и таким образом обеспечена его более высокая чувствительность, а также упрощена оптическая система за счет использования полупроводниковой оптической пары в ИК-диапазоне с интерференционным фильтром, изготовленным на основе современных отечественных технологий. Благодаря высокой чувствительности удалось значительно уменьшить объем кюветы ( 1 мл), что позволило улучшить метрологические характеристики прибора, уменьшить расход реагентов и упростить процесс подготовки пробы к измерению. Повышение чувствительности потребовало принятия мер к снижению помех как электрических, так и тепло- [c.139] В З тих случаях при составлении электронных схем окислительно-восстановительных реакций целесообразно учесть суммарное число электронов, которое теряет молекула восстановителя. Исходя из того, что молекула FeSj теряет в совокупности [c.142] Для нейтрального атома углерода с шестью электронами схема распределения электронных состояний выглядит так, как показано на рис. 1-1, а. [c.17] Подчинение этих процессов разным законам приводит к тому, что ток ДЭС затухает раньше фарадеевского (рис. 5.15,а). Это обстоятельство позволяет разделить ток двойного слоя и фарадеевский ток, проводя измерение в момент времени т, и исключить первый. Конечно, при этом приходится иметь дело с весьма малыми силами тока, но современные электронные схемы позволяют без особых искажений усилить малые токи до любых значений, необходимых для управления регистрирующим прибором, скажем, самописцем. [c.285] Почему в молекуле образуется только ковалентная связь, а в молекуле С1а возникают дативные связи. Как зто различие влияет на сравнительную величину энергии связи и прочность этих молекул Дать электронную схему возникновения дативной связи при образовании молекулы. [c.130] Написать электронные схемы молекул N 0 на основе метода ВС и N0 1 а основе метода МО, Какова ковалентность каждого атома азота в молекуле N 0 Пара- или диамагнитна молекула N0 Чем это объясняется [c.147] Дать электронную схему молекулы азотной кислоты, учитывая возмож ный ковалентный и донорно-акцепторный характер связи между атомами. Чему равна ковалентность азота в молекуле азотной кислоты [c.147] Как изменяются а) восстановительные свойства ионов в ряду Ge - -, Sn +, Pb - , б) окислительные свойства в ряду Ge , Sn- - , Pb+ Указать наиболее слабый восстановитель и наиболее сильный окислитель и написать электронные схемы этих элементов в соответствующей степени окисления. [c.163] Для того чтобы число электронов, которое теряет восстановитель S , стало равно числу электронов переходящих к окислителю С , следует второе равенстио умножить на 4. После сложения обоих равенств получаем электронную схему реакции [c.143] Изменение состояния окисления претерпевают железо Fe и хром О Из электронной схемы реакции, расчет которой целесообразно вести на два атома хрома (по числу атомов в молекуле К2СГ2О,) [c.143] Для приведенных ниже реакций составить электронные схемы и закончить сэстав.тение уравнений [c.147] Графовводы предназначаются для ввода текста или графиков с фотопленки, фотобумаги или других документов в ЭВМ. В графовводе с фотопленки обычно используются те же блоки, что и в графопостроителе. В графовводе, для которого исходный документ представляет собой изображение на бумаге, вместо проходящего пучка света используется отраженный свет. В любом случае через оптико-электронную схему информация о точках документа преобразуется в электрические сигналы, поступающие в ЭВМ. [c.138] Применение радиоактивного излучения для определения влагосодержання масел- основано на эффекте отражения нейтронов, наблюдаемом при облучении пробы обводненного масла. Приборы этого типа снабжены измерительной головкой для определения интенсивности излучения и электронной схемой для обработки результатов и выдачи информации. [c.39] Периферийные устройства и их блоки управления связываются с каналом посредством стандартной системы сопряжения. Физически сопряжение представляет собой набор шин, про-ходяших через все периферийные устройства, и электронных схем, формирующих сигналы, проходящие через эти шины. Шины, предназначенные для передачи по ним информации, называют информационной магистралью, а шины, предназначенные для передачи управляющих сигналов — служебными. [c.55] Рассмотрим работу операционного блока, перемножающего входные напряжения U[ и i/2- Такая операция может осуществляться различными способами. Например, если в потенциометре положение скользящего контакта устанавливается специальным приводом в соответствии с величиной напряжения U, а напряжение Ui приложено к потенциометру, то на его выходе будет напряжение UiU2. Такое устройство срабатывает довольно медленно. 2 того недостатка лишена электронная схема, основанная на соотношении [c.336] Лабораторией Ю.С. Лопатто в этот период было создано несколько марок отечественного стеклоуглерода, материала абсолютно непроницаемого для жидкостей и газов, что обусловлено его неупорядоченной кристаллической структурой и закрытой пористостью. Благодаря ограниченной подвижности примесей в этом материале он оказался необходимым при изготовлении электронных схем, а также как великолепный заменитель платины в лабораторной посуде, используемой при высоких температурах и в агрессивных средах типа тех, при которых получают люминофоры. [c.118] Соответственно различают потенциометрический, амперомет-рический и кондуктометрический способы индикации конца титрования. В потенциометрическом способе, заимствованном из потенциометрического метода титрования, чаще всего используют либо стеклянный электрод — для кислотно-основного титрования, либо платиновый — для окислительно-восстановительного титрования. Поскольку потенциал стеклянного электрода связан с pH раствора простой зависимостью = 0,059 pH, то очевидно, что вблизи от точки эквивалентности, когда происходит резкое изменение pH раствора, должно происходить и резкое изменение потенциала электрода, которое может быть фиксировано визуально, либо автоматически (например, самописцем) с помощью соответствующей электронной схемы. Аналогичная зависимость существует для окислительно-восстаиови-тельной системы [c.261] Примечание, Электронная схема титратора в режиме автоматического титрования срабатывает в том случае, если перед титрованием на блоке БОЭТ горят все три сигнальные лампочки. В противном случае необходимо перебросить переключатель БОЭТ титрование в положение кислотой (должна загореться лампочка белого цвета), а переключатель выдержка — в положение 5 (через 5 с должна загореться лампочка красного цвета). После этого указанные переключатели вернуть в исходное положение по пунктам 7а и 76 [c.142] chem21.info Азот – типичный неметаллический элемент, по электроотрицательности (3,0) уступает лишь фтору и кислороду. В обычных условиях представляет собой газ без цвета и запаха. Температуры плавления ru.solverbook.com Как составлять электронные формулы химических элементов? Задача составления электронной формулы химического элемента не самая простая. Научившись раз, дальше вы легко будете справляться с составлением формулы всех химических элементов. Итак, алгоритм составления электронных формул элементов такой: Вот электронные формулы некоторых химических элементов: Ниже можно увидеть пример, как правильно составлять электронные формулы химических элементов. Составить электронные формулы химических элементов нужно таким способом: нужно посмотреть номер элемента в таблице Менделеева, таким образом узнать сколько у него электронов. Затем нужно узнать количество уровней, который равен периоду. Затем пишутся подуровни и они заполняются: -Первым делом вам надо определить число атомов согласно таблицы Менделеева. -Далее следует определить число энергетических уровней - основополагающим здесь будет являться номер периода, в котором размещн данный элемент. -Далее за эти вам необходимо приступить к разбитию уровней на подуровни, заполняемые электронами. При этом основываться стоит на принципе наименьшей энергии. Для составления электронной формулы вам понадобится периодическая система Менделеева. Находите ваш химический элемент там и смотрите период - он будет равен числу энергетических уровней. Номер группы будет соответствовать численно количеству электронов на последнем уровне. Номер элемента будет количественно равен числу его электронов.Так же вам четко надо знать, что на первом уровне есть максимум 2 электрона, на втором - 8, на третьем - 18. Это основные моменты. Ко всему прочему в интернете (в том числе и нашем сайте) вы можете найти информацию с уже готовой электронной формулой для каждого элемента, так вы сможете проверить себя. Составление электронных формул химических элементов очень даже сложный процесс, без специальных таблиц тут не обойтись, да и формул нужно применять целую кучу. Вкратце для составления нужно пройти по этим этапам: Нужно составить орбитальную диаграмму, в которой будет понятие отличия электронов друг от друга. В диаграмме выделяются орбитали и электроны. Электроны заполняются по уровням, снизу в верх и имеют несколько подуровней. Итак вначале узнам общее количество электронов заданного атома. Заполняем формулу по определнной схеме и записываем - это и будет электронной формулой. Например у Азота эта формула выглядит так, сначала разбираемся с электронами: И записываем формулу: Чтобы понять принцип составления электронной формулы химического элемента, для начала нужно определить по номеру в таблице Менделеева общее количество электронов в атоме. После этого нужно определить число энергетических уровней, взяв за основу номер периода, в котором находится элемент. После этого уровни разбиваются на подуровни, которые заполняют электронами, основываясь на Принципе наименьшей энергии. Можно проверить правильность своих рассуждений, заглянув, например, сюда. Составив электронную формулу химического элемента, можно узнать, сколько электронов и электронных слоев в конкретном атоме, а также порядок их распределения по слоям. Для начала определяем порядковый номер элемента по таблице Менделеева, он соответствует числу электронов. Количество электронных слоев указывает на номер периода, а количество число электронов на последнем слое атома соответствует номеру группы. Электронная формула химического элемента показывает сколько электронных слоев и сколько электронов содержится в атоме и как они распределены по слоям. Чтобы составить электронную формулу химического элемента, нужно заглянуть в таблицу Менделеева и использовать полученные сведения для данного элемента. Порядковый номер элемента в таблице Менделеева соответствует количеству электронов в атоме. Число электронных слоев соответствует номеру периода, число электронов на последнем электронном слое соответствует номеру группы. Необходимо помнить, что на первом слое находится максимум 2 электрона 1s2, на втором - максимум 8 (два s и шесть р: 2s2 2p6), на третьем - максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10). Например, электронная формула углерода: С 1s2 2s2 2p2 (порядковый номер 6, номер периода 2, номер группы 4). Электронная формула натрия: Na 1s2 2s2 2p6 3s1 (порядковый номер 11, номер периода 3, номер группы 1). Для проверки правильности написания электронной формулы можно заглянуть на сайт www.alhimikov.net. Составление электронной формулы хим.элементов на первый взгляд может показаться довольно сложным занятием, однако все станет понятно, если придерживаться следующей схемы: А как узнать число энергетических уровней? Просто посмотрите таблицу Менделеева: это число равно номеру периода, в котором данный элемент находится. Например, электронная формула скандия будет выглядеть таким образом: info-4all.ruСоставьте электронные схемы для валентности. § 3-5, 7 вопрос. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г. Составьте электронные схемы электронные
Составьте электронные схемы для валентности. § 3-5, 7 вопрос. Химия, 11 класс, базовый уровень, Рудзитис Г.Е., Фельдман Ф.Г.

 В молекуле оксида углерода две связи образованы за счет двух неспаренных электронов атома углерода и двух неспаренных электронов атома кислорода. У атома кислорода есть еще пара электронов на 2р-орбитали, а у атома углерода ‒ свободная 2р-орби- таль. Пара электронов переходит от атома кислорода к атому углерода, образуют донорно-акцепторную связь. Электронную формулу оксида углерода (II) можно изобразить так:
В молекуле оксида углерода две связи образованы за счет двух неспаренных электронов атома углерода и двух неспаренных электронов атома кислорода. У атома кислорода есть еще пара электронов на 2р-орбитали, а у атома углерода ‒ свободная 2р-орби- таль. Пара электронов переходит от атома кислорода к атому углерода, образуют донорно-акцепторную связь. Электронную формулу оксида углерода (II) можно изобразить так:  (стрелочкой обозначена донорно-акцепторная связь).б) Молекула азотной кислоты. Электронные схемы атомов водорода, кислорода и азота:
(стрелочкой обозначена донорно-акцепторная связь).б) Молекула азотной кислоты. Электронные схемы атомов водорода, кислорода и азота: 
 Атом водорода образует за счет единственного электрона связь с атомом кислорода. Второй электрон атома кислорода участвует в образовании связи с атомом азота:
Атом водорода образует за счет единственного электрона связь с атомом кислорода. Второй электрон атома кислорода участвует в образовании связи с атомом азота:  У атома азота остается два неспаренных электрона, и он образует две связи со вторым атомом кислорода:
У атома азота остается два неспаренных электрона, и он образует две связи со вторым атомом кислорода:  У атома азота осталась еще электронная пара на 2s-орбитали. В третьем атоме кислорода происходит спаривание электронов, и образуется свободная орбиталь:
У атома азота осталась еще электронная пара на 2s-орбитали. В третьем атоме кислорода происходит спаривание электронов, и образуется свободная орбиталь:  Пара электронов от атома азота переходит на освободившуюся орбиталь атома кислорода и образуется донорно-акцепторная связь:
Пара электронов от атома азота переходит на освободившуюся орбиталь атома кислорода и образуется донорно-акцепторная связь: 
Составьте электронные схемы, отражающие валентность азота в азотной кислоте и валентность углерода и кислорода в оксиде углерода (II).
Электронные схемы - Справочник химика 21
Составить электронные схемы строения атомов калия и цезия. Какой из этих элементов является более сильным восстановителем Почему [c.263]Составьте электронные схемы, отражающие валентность азота
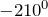 и кипения
и кипения 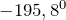 азота очень низкие; он плохо растворяется в воде и других растворителях.Молекула азота двухатомна —
азота очень низкие; он плохо растворяется в воде и других растворителях.Молекула азота двухатомна — 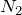 . Между атомами азота в молекуле есть тройная связь, вследствие чего его молекула исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.Азот — седьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VA группе. В ядре атома азота содержится 7 протонов и 7 нейтронов (массовое число равно 14), а вокруг ядра по двум орбитам движутся 7 электронов.Электронная формула атома азота в основном состоянии имеет следующий вид:
. Между атомами азота в молекуле есть тройная связь, вследствие чего его молекула исключительно прочная. Молекулярный азот химически малоактивен, слабо поляризуется.Азот — седьмой по счету элемент Периодической таблицы Д.И. Менделеева. Он находится во втором периоде во VA группе. В ядре атома азота содержится 7 протонов и 7 нейтронов (массовое число равно 14), а вокруг ядра по двум орбитам движутся 7 электронов.Электронная формула атома азота в основном состоянии имеет следующий вид: 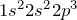 . Электронно-графическая формула азота имеет вид:
. Электронно-графическая формула азота имеет вид: В атоме азота в основном состоянии имеется три неспаренных электрона. Это свидетельствует о том, что валентность азота равна трем. Однако, несмотря на тот факт, что для азота не характерно наличие возбужденного состояния, данный элемент способен проявлять в своих соединениях валентности I, II, IV и V.Это и ответ на вопрос задачи «составьте электронные схемы, отражающие валентность азота».
В атоме азота в основном состоянии имеется три неспаренных электрона. Это свидетельствует о том, что валентность азота равна трем. Однако, несмотря на тот факт, что для азота не характерно наличие возбужденного состояния, данный элемент способен проявлять в своих соединениях валентности I, II, IV и V.Это и ответ на вопрос задачи «составьте электронные схемы, отражающие валентность азота».Как составлять электронные формулы химических элементов?
интернет-магазин светодиодного освещения
Пн - Вс с 10:30 до 20:00
Санкт-Петербург, просп. Энгельса, 138, корп. 1, тк ''Стройдвор''












Поделиться с друзьями: