Содержание
Ламповые диоды
Наверх
Простейшей
электронной лампой является диод. Слово
«диод», основой которого служит греческий
корень «ди» — два, означает, что в этой
лампе имеются два электрода.
Первый
из этих электродов — катод, служащий для
получения потока электронов. Вторым
электродом является металлическая
пластинка — анод. Таким образом, диод —
двухэлектродная электронная лампа —
представляет собой стеклянный или
металлический баллон, из которого
выкачан воздух и внутри которого
находятся катод и анод. От этих электродов
сквозь стенки баллона проходят выводы.
Если баллон стеклянный, то выводы
впаиваются в стекло. Если же баллон
металлический, то выводы выходят через
стеклянные бусинки, впаянные в металл.
От анода делают один вывод. В случае
катода прямого накала выводы делают от
концов нити. Если катод подогревный, то
делают два вывода от подогревающей нити
и один от собственного катода.
Внутри
баллона лампы создают высокий вакуум.
Если катод нагреть до нужной температуры,
то начнется электронная эмиссия, и
электроны образуют вокруг катода своего
рода электронное облачко. Образование
Образование
этого облачка объясняется тем, что
электроны, вылетающие из катода,
испытывают отталкивающее действие со
стороны ранее вылетевших электронов,
поэтому они не могут отлететь на
значительное расстояние от катода.
Часть электронов, имеющих наименьшие
скорости, падает обратно на катод. Однако
электронное облачко стабилизируется:
на катод падает столько же электронов,
сколько из него вылетает. Облачко
представляет собой запас свободных
электронов в вакууме.
Второй
электрод — анод — предназначается для
использования электронов, вылетающих
из катода, и для управления ими. С этой
целью к катоду и аноду лампы подводится
электрическое напряжение, например от
батареи.
Это
напряжение можно подвести к лампе двумя
способами: минус источника напряжения-
к катоду и плюс — к аноду, или наоборот.
Если присоединить плюс источника
напряжения к катоду, а минус — к аноду,
то электроны, вылетающие из катода и
сконцентрированные в окружающем его
электронном облачке, не будут использованы.
Отрицательно заряженный анод будет
отталкивать электроны.
Иначе
будет обстоять дело тогда, когда мы
присоединим плюс источника напряжения
к аноду, а минус — к катоду и одновременно
в цепь батареи включим миллиамперметр.
При таком присоединении миллиамперметр
отметит прохождение тока. По цепи:
батарея — катод лампы — пространство
между катодом и анодом лампы — миллиамперметр
— батарея будут двигаться электроны.
Ток в цепи возникает тогда, когда плюс
батареи присоединен к аноду, а минус —
к катоду. Этим и объясняется название
второго электрода лампы: «анод» (в
электротехнике анодом принято называть
электрод, соединенный с положительным
полюсом источника тока, а катодом —
электрод, соединенный с отрицательным
полюсом). В соответствии с этим текущий
через лампу ток, образованный потоком
электронов, несущихся от катода к аноду,
называют анодным током. Анодный ток
обозначается обычно символом IA, а
напряжение на аноде — символом Uа. В
отличие от него напряжение накала лампы
обозначается символом UH.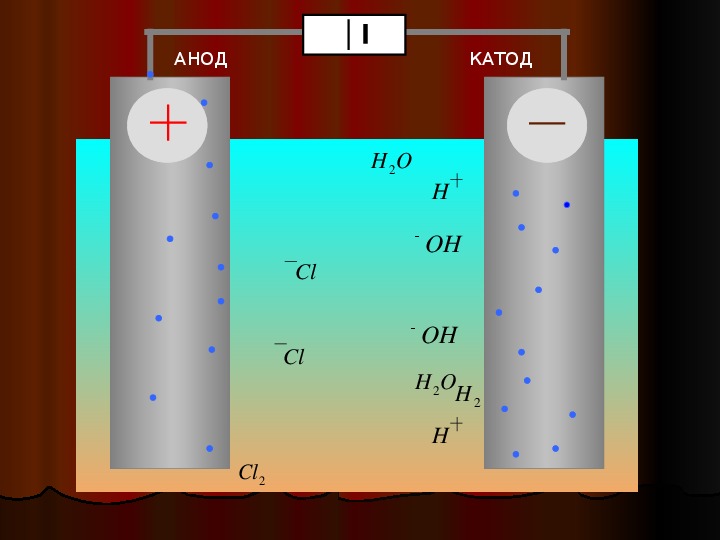
Чем
же определяется величина IA?
Чтобы
ответить на этот вопрос, произведем
такой опыт. Раскалим катод до нужной
температуры и будем подавать на анод
положительное напряжение, начиная с
самого небольшого и постепенно увеличивая
его. При каждом изменении анодного
напряжения будем по миллиамперметру
отмечать величину тока в цепи. Если мы
затем по записанным отсчетам построим
график, откладывая по горизонтальной
оси величины напряжения на аноде, а по
вертикальной соответствующие величины
анодного тока, то получим кривую, подобную
изображенной на рис. 2.
При
отсутствии анодного напряжения, т. е.
при (IA=0, электроны к аноду не притягиваются,
анодный ток равен нулю IA=0). Анодный ток
возникает после того, как на анод подано
положительное напряжение. По мере его
увеличения анодный ток будет возрастать,
причем рост его до точки А вначале идет
медленно, а затем быстрее. Такое быстрое
возрастание тока продолжается, пока он
не достигнет некоторого значения,
соответствующего точке Б. При дальнейшем
При дальнейшем
повышении анодного напряжения рост
анодного тока замедляется. Наконец, в
точке В он достигнет наибольшей величины.
Дальнейшее повышение анодного напряжения
уже не сопровождается увеличением
анодного тока.
Кривую,
показывающую зависимость величины
анодного тока двухэлектродной лампы
от напряжения на ее аноде, называют
вольт-амперной характеристикой диода.
Чем
же объясняется такая форма характеристики
диода?
При
отсутствии напряжения на аноде все
излучаемые катодом электроны скапливаются
вокруг него, образуя электронное облачко.
При появлении на аноде небольшого
положительного напряжения некоторые
электроны, обладающие большей скоростью,
чем остальные, начинают отрываться от
облачка и устремляются к аноду, создавая
небольшой анодный ток. По мере увеличения
анодного напряжения все большее
количество электронов будет отрываться
от облачка и притягиваться анодом.
Наконец, при достаточно большом напряжении
на аноде все электроны, окружающие
катод, будут притянуты, электронное
облачко совершенно «рассосется». Это
Это
соответствует точке В на характеристике
лампы. При таком анодном напряжении все
вылетающие из катода электроны будут
немедленно притягиваться анодом.
Дальнейшее увеличение анодного тока
при данной величине накала невозможно.
Для этого нужны дополнительные электроны,
а их взять негде, вся эмиссия катода
исчерпана.
Анодный
ток такой величины, какая устанавливается
при полном использовании всей эмиссии
катода, называется током насыщения.
Увеличить ток насыщения можно только
одним способом — повысить накал катода,
но этот способ не применяется, потому
что он сокращает срок службы катода.
До
сих пор мы говорили об аноде как о
металлической пластинке. В практических
конструкциях диодов анод обычно имеет
форму цилиндра или коробки без двух
стенок (часто с закругленными углами),
окружающей катод. В последнем случае
нить имеет вид латинской буквы V или W.
При
таких конструкциях анодов все излучаемые
катодами электроны с одинаковой силой
притягиваются анодами.
Для
уменьшения нагрева анода его часто
снабжают ребрами или крылышками, которые
способствуют лучшему отводу от него
тепла.
Триоды
Наверх
Электронные
лампы приобрели свои исключительно
ценные свойства лишь после того, как в
диод был введен третий электрод — сетка.
Это открыло перед электронной лампой
огромные возможности. Сетка помещается
между катодом и анодом.
Название
«сетка» объясняется тем, что в первых
конструкциях ламп она действительно
представляла собой сетку или решетку.
В дальнейшем сетку начали делать в виде
проволочной спирали, окружающей катод,
но первоначальное название «сетка»
удержалось за этим электродом до
настоящего времени.
Какую
же роль выполняет сетка?
Работа
триода, как всякой электронной лампы,
основана на существовании электронного
потока между катодом и анодом. Сетка
находится между этими электродами,
поэтому электроны, устремляющиеся от
катода к аноду, встречают ее на своем
пути и сетка управляет количеством
электронов, летящих к аноду.
Разумеется,
сетку нельзя рассматривать как
механическое препятствие для электронов.
Промежутки между витками сетки, как бы
густа она ни была, всегда будут огромны
по сравнению с размерами электронов.
Если, например, представить себе электрон
в виде футбольного мяча, то расстояния
между витками сетки в том же масштабе
будут равны расстояниям между планетами
нашей вселенной.
Сетка,
как и другие электроды, имеет вывод
наружу. Посмотрим, изменится ли что-либо
в работе лампы, если вывод сетки
присоединить к катоду. При таком
соединении сетка приобретает потенциал
катода. Между сеткой и катодом не будет
никакого электрического поля, поэтому
витки сетки окажут очень слабое действие
на электроны, летящие от катода к аноду.
Возможно, что отдельные электроны,
столкнувшиеся с витками сетки, застрянут
на них. Но в этом случае сетка зарядится
отрицательно по отношению к катоду, и
излишние электроны немедленно стекут
с нее на катод по соединительному
проводнику, выравнивая таким образом
потенциалы сетки и катода.
Положение
резко изменится, если сообщить сетке
какой-либо потенциал относительно
катода. Осуществить это можно, включив,
Осуществить это можно, включив,
например, между катодом и сеткой батарею.
Если
батарея окажется включенной так, что
сетка зарядится отрицательно (рис. 4),
то последняя начнет отталкивать электроны
обратно к катоду. Если в анодную цепь
лампы включен измерительный прибор, то
он зарегистрирует уменьшение анодного
тока. Прорываться к аноду сквозь сетку
смогут лишь те электроны, которые
обладают достаточно большой скоростью.
При
значительном отрицательном потенциале
сетки даже те электроны, которые обладают
наибольшей скоростью, не смогут преодолеть
ее отталкивающее действие. Анодный ток
прекратится. Лампа, как говорят, будет
заперта. Если батарею (которую мы назовем
сеточной) присоединить так, чтобы сетка
была заряжена положительно относительно
катода, то возникшее между катодом и
сеткой электрическое поле станет
ускорять движение электронов. В этом
случае прибор в цепи анода покажет
увеличение анодного тока. Теперь смогут
достигать анода и те электроны, которые
при вылете из катода обладали малой
скоростью и без помощи сетки не смогли
бы преодолеть путь до анода.
Чем
выше положительный потенциал сетки,
тем больше она способствует увеличению
скорости электронов, излучаемых катодом.
В соответствии с этим возрастает и
анодный ток. При этом, разумеется,
некоторая часть электронов притягивается
и к сетке, но при правильной конструкции
лампы количество этих электронов
невелико по сравнению с общей эмиссией
катода. Подавляющее число электронов
вследствие притяжения сеткой получает
столь большое ускорение, что они
проскакивают через промежутки между
ее витками и устремляются к аноду,
притяжение которого еще больше ускоряет
их. Лишь те электроны, которые на своем
пути сталкиваются непосредственно с
витками сетки или оказываются в
непосредственной близости от них,
притянутся к сетке и создадут в ее цепи
ток, получивший название сеточного
тока,
В
дальнейшем разность потенциалов между
сеткой и катодом будем называть
напряжением на сетке. Если потенциал
сетки положителен по отношению к катоду,
это напряжение тоже считается
положительным, а если потенциал сетки
по отношению к катоду отрицателен, то
и напряжение на сетке имеет отрицательный
знак. По мере увеличения положительного
По мере увеличения положительного
напряжения на сетке количество
притягиваемых ею электронов увеличивается
и при большом напряжении сеточный ток
может стать очень большим.
Процессы,
происходящие в цепях анода и сетки
трехэлектродной лампы, можно наглядно
показать при помощи графика. По
горизонтальной оси графика откладывают
напряжение на сетке в вольтах, а по
вертикальной — величину анодного тока
в миллиамперах. Точка пересечения осей,
т. е. начало координат, соответствует
нулевому потенциалу сетки. Вправо от
нее откладывается положительное
напряжение на сетке, влево — отрицательное.
Для
получения данных, нужных для построения
графика, соберем схему, которая даст
возможность изменять по желанию
напряжение на сетке при неизменном
напряжении на аноде и, разумеется, при
неизменном напряжении накала. Отложив
на графике величины анодного тока,
соответствующие различным значениям
напряжения на сетке, в виде кривой, мы
получим так называемую анодно-сеточную,
или входную, характеристику триода,
показывающую зависимость анодного тока
лампы от величины и знака напряжения
на сетке.
При
некотором отрицательном напряжении на
сетке анодный ток прекращается —
становится равным нулю. Эта точка
считается началом характеристики, так
как достаточно самого малого уменьшения
отрицательного напряжения на сетке,
чтобы анодный ток возник. На приведенном
для иллюстрации графике этой точке
соответствует напряжение на сетке,
равное 8 в.
На
графике внизу изображена и характеристика
сеточного тока. Он начинается примерно
при нулевом напряжении сетки и возрастает
по мере увеличения положительного
напряжения на ней. Влево от нуля, в
области отрицательных напряжений на
сетке, ток в ее цепи отсутствует. Однако
анодный ток в этой области имеется, и
величина его зависит от значения
отрицательного потенциала сетки. При
отрицательном потенциале на сетке она
управляет величиной анодного тока, не
потребляя никакого тока, т. е. не потребляя
энергии. Она ведет себя как электрическая
заслонка, регулирующая доступ электронов
к аноду лампы, но не расходующая энергии
на свою работу. Это обстоятельство
Это обстоятельство
вместе с уже отмеченным ранее мгновенным
изменением величины анодного тока при
изменениях напряжения на сетке
представляет замечательную особенность
электронных ламп с сеткой, обеспечивающую
им самые разнообразные применения.
На
использовании управляющего действия
сетки и основана способность лампы
усиливать подводимое к ней напряжение.
Увеличивая или уменьшая отрицательное
напряжение на сетке, мы тем самым
заставляем анодный ток соответственно
ослабляться или возрастать. Если в
анодную цепь лампы включить резистор
(сопротивление) R, то анодный ток, проходя
по нему, будет создавать на нем падение
напряжения. Любое увеличение или
уменьшение анодного тока приведет к
изменению величины падения напряжения
на резисторе. Кривая, по которой изменяется
анодный ток, имеет такую же форму, как
и переменное напряжение на сетке; поэтому
и форма изменения напряжения на резисторе
будет такой же. Однако при этом изменения
напряжения на резисторе будут во много
раз больше по величине, потому что малые
изменения напряжения на сетке создают
большие изменения величины анодного
тока даже при условии, что резистор в
анодной цепи лампы имеет достаточно
большое сопротивление.
Колебания
напряжения на резисторе будут представлять
собой как бы увеличенную фотографию
колебаний напряжения на сетке.
Наклон
характеристики у различных ламп
неодинаков. У одних характеристика идет
круче, у других — более полого. Чем круче
поднимается характеристика, тем сильнее
будут сказываться изменения сеточного
напряжения на величине анодного тока
и, следовательно, тем больше будет
усиление лампы.
Из
этого можно сделать вывод, что чем круче
характеристика лампы, тем большими
усилительными способностями она
обладает.
Катод плюс или минус? — Segirt Last Minute Последние новости
Содержание
Катод плюс или минус?
Катод — это электрод, на котором происходит восстановление. Это проводящий наконечник, который можно определить как противоположность анода, положительное и отрицательное значение которого меняется в зависимости от ситуации. Если нет необходимости во внешнем воздействии для пропускания тока через цепь, катод становится отрицательным выводом.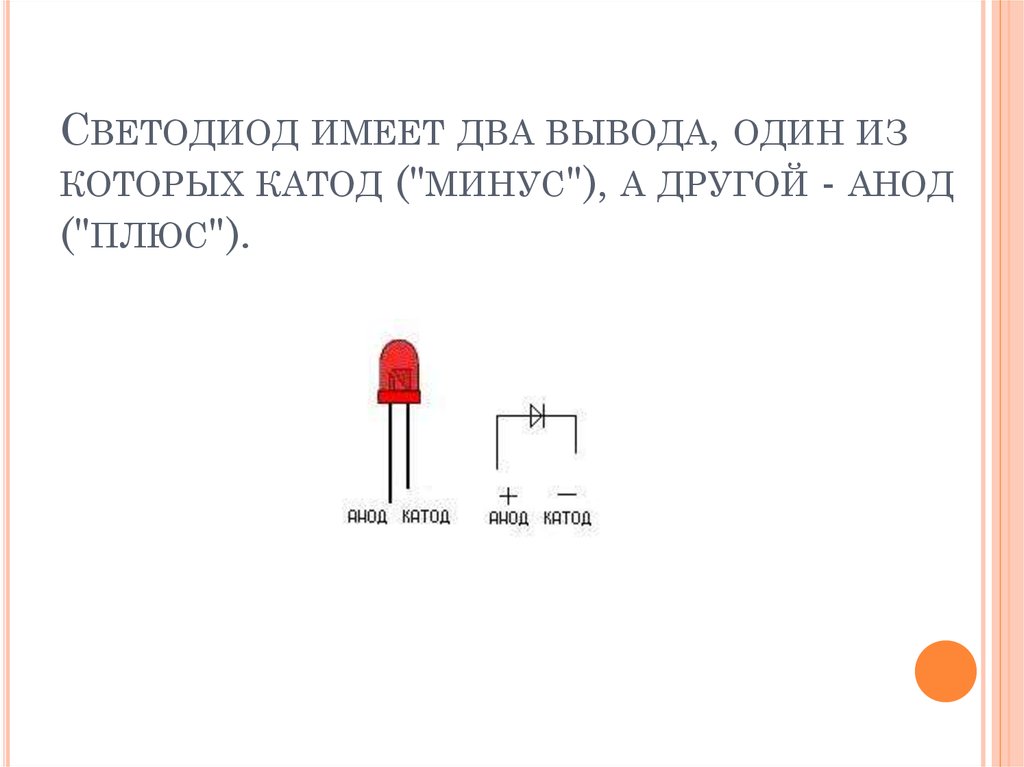 В реакции оцинкованной химической батареи катод заряжается положительно.
В реакции оцинкованной химической батареи катод заряжается положительно.
Что такое анод и катод?
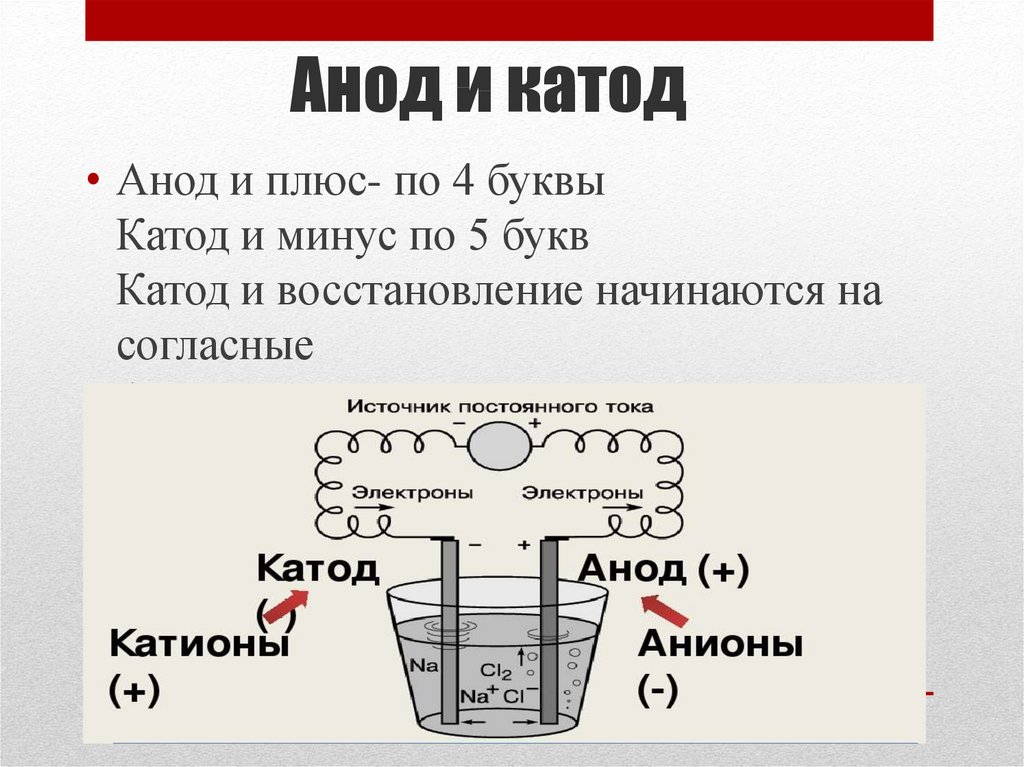
Анод и катод — это процесс, рассматриваемый в рамках генератора постоянного тока. Электрод, соединенный с положительной частью генератора постоянного тока, называется анодом. Точно так же электрод, подключенный к отрицательному полюсу, называется катодом.
Какой знак анодного электрода?
Это электрод, на котором * происходит окисление в аккумуляторной системе. . В системах с гальваническими батареями (т. е. когда система установлена, если ток в цепи проходит сам по себе) конец анода (+) представляет собой конец анода (-) в системах с электролитическими батареями (если требуется внешний потенциал для тока). течь по цепи).
Является ли катод положительным при электролизе?
Что такое катод? В электролизере электрод, соединенный с минусовым (-) полюсом генератора, называется катодом. анод-катод; Анод заряжен положительно (+), катод — отрицательно (-) заряжены электроды.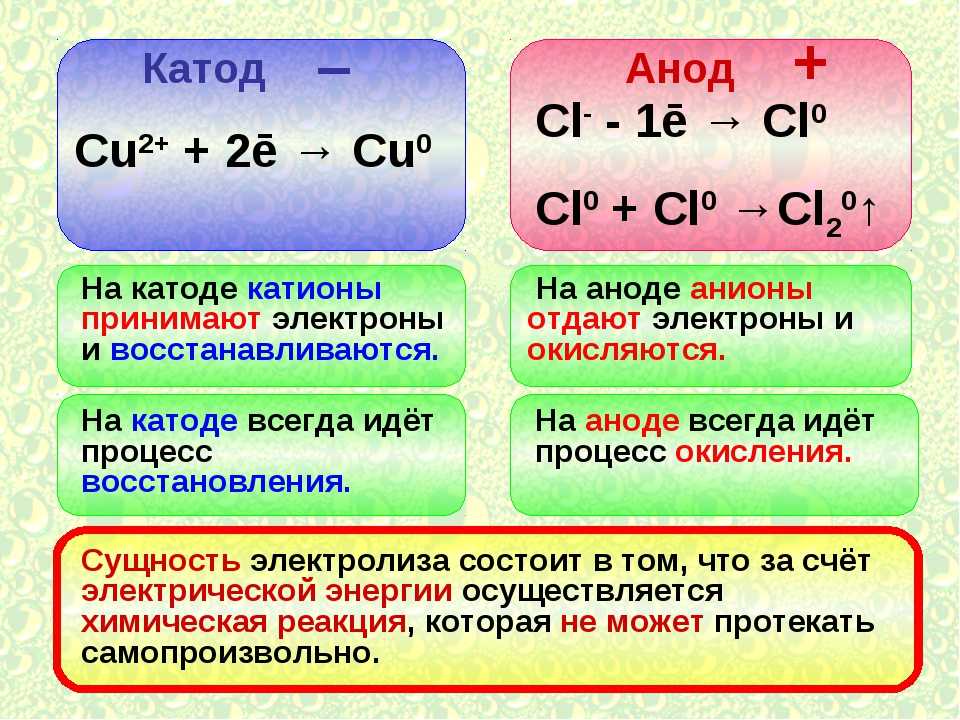
Куда уходят отрицательные ионы?
Заряженные (-) ионы в растворе во время электролиз — анод, (+) заряженные ионы идут к катоду. Анионы окисляются на поверхности анода, а катионы восстанавливаются на поверхности катода. Термодинамически электролиз восстановления меди происходит при 0,89 В.
Какой полюс является анодом?
Что такое анод? В сосуде для электролиза электрод, соединенный с положительным (+) полюсом генератора, называется анодом.
Из какого материала катод?
Катодные материалы являются основным компонентом литий-ионных аккумуляторов; определяет плотность энергии элемента по напряжению и/или емкости элемента.
Является ли анод окисленным или восстановленным?
Во время электролиза восстановление происходит на катоде, а окисление происходит на анод.
Чем заряжен анод?
Анод представляет собой положительно заряженный электролит. Его также можно объяснить как электрод, на котором происходит окисление в окислительно-восстановительных реакциях. Проводящий наконечник, который можно определить как антикатод, положительное и отрицательное значение которого меняются в зависимости от ситуации. В реакции электролиза анод становится положительной клеммой (обычно это так).
Проводящий наконечник, который можно определить как антикатод, положительное и отрицательное значение которого меняются в зависимости от ситуации. В реакции электролиза анод становится положительной клеммой (обычно это так).
Происходит ли электрический ток от анода к катоду?
Было показано, что материалы, к которым приложен электрический ток, разлагаются на компоненты и собираются на аноде (+ заряженный электрод) и катоде (- заряженный электрод). Процесс разложения химических соединений, растворенных в жидкости, на элементы с помощью электрической энергии называется «электролиз».
Замыкает ли солевой мостик цепь?
Солевой мостик замыкает цепь обеспечивая электрическую нейтральность и позволяя аккумулятору работать. I. Пока батарея работает, масса твердого цинка на аноде уменьшается, а концентрация ионов цинка увеличивается.
Где находятся отрицательные ионы?
Отрицательные ионы молекулы, которыми мы дышим и не имеют ни запаха, ни вкуса. В природе он встречается в высоких концентрациях в горах, водопадах, на побережье и в лесах.
В природе он встречается в высоких концентрациях в горах, водопадах, на побережье и в лесах.
Читать: 18
Примечания по катоду и аноду от Unacademy
Введение
Поток тока определяет анод и катод. Ток, в его самом широком смысле, относится к любому движению электрического заряда. Однако имейте в виду, что направление тока определяется тем, куда будет двигаться положительный заряд, а не тем, куда будет двигаться отрицательный заряд. Так, если электроны движутся в ячейке, ток течет в противоположном направлении. Почему он определяется таким образом? Кто знает, но это правило. Когда заряд несут носители положительного заряда, такие как ионы или протоны, ток течет в том же направлении. Ток течет в противоположном направлении от носителей отрицательного заряда, таких как электроны в металлах.
Катод
Отрицательно заряженный электрод является катодом. Катод имеет тенденцию притягивать катионы или положительно заряженные частицы.
Катод является либо донором, либо источником электронов. Он способен принимать положительные заряды. Поскольку катод может генерировать электроны, которые обычно являются электрическими частицами, которые и совершают фактическое движение, можно сказать, что катоды генерируют заряд или что ток течет от катода к аноду. Это может сбивать с толку, потому что направление тока определяется движением положительного заряда. Только имейте в виду, что любое движение заряженных частиц является текущим.
В поляризованном электрическом устройстве катод представляет собой металлический электрод, по которому течет ток. Анод, с другой стороны, представляет собой электрод в поляризованном электрическом устройстве, через который протекает ток из внешней цепи. Катоды названы в честь катионов (положительно заряженных ионов), а аноды названы в честь анионов (отрицательно заряженных ионов).
Катод необходим для получения электронов от анода. И анод, и катод погружены в раствор электролита, и электричество течет от отрицательной к положительной части вашей батареи через проводник.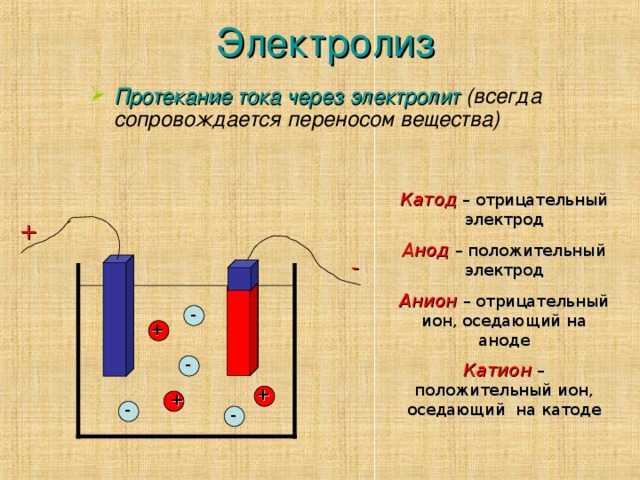 В двух словах, так аккумулятор вырабатывает электричество.
В двух словах, так аккумулятор вырабатывает электричество.
Катод может быть изготовлен из любого материала, если он является эффективным окислителем, сохраняющим стабильность при контакте с электролитом. Поскольку они имеют полезное рабочее напряжение, оксиды металлов являются отличными катодными материалами. Оксид меди, оксид лития и оксид графики являются их примерами.
Анод
Анод — это электрод в поляризованном электрическом устройстве, который получает ток от внешней цепи. Катод, с другой стороны, представляет собой электрод в поляризованном электрическом устройстве, через который протекает ток. Катоды названы в честь катионов (положительно заряженных ионов), а аноды названы в честь анионов (отрицательно заряженных ионов).
Положительно заряженный электрод известен как анод. Электроны или анионы притягиваются к аноду. Анод может быть источником положительного заряда или акцептором электронов.
Анод представляет собой металл, который окисляется, например, цинк или литий, и, таким образом, теряет электроны. Он плавает в растворителе электролита и медленно разрушается по мере того, как электроны текут по проводнику к катоду.
Он плавает в растворителе электролита и медленно разрушается по мере того, как электроны текут по проводнику к катоду.
Проводник (будь то металлическая проволока или трубка) — это то, как мы получаем доступ к электричеству, вырабатываемому анодом, и, в конечном счете, как батарея питает наши устройства. Аккумулятор умрет, как только анод полностью разрушится (или потеряет заряд).
Разница между катодом и анодом
Анод — это электрод в поляризованном электрическом устройстве, который получает ток от внешней цепи.
Катод, с другой стороны, представляет собой электрод в поляризованном электрическом устройстве, через который протекает ток. Катоды названы в честь катионов (положительно заряженных ионов), а аноды названы в честь анионов (отрицательно заряженных ионов).
Анод — это действительно заряженный отрицательный электрод в устройстве, потребляющем электричество. Примерами таких устройств являются диоды, электролитические элементы при производстве водорода, а также вторичные аккумуляторные элементы при подзарядке аккумуляторов. Однако, поскольку в силовом устройстве поток электронов реверсирован, анод является отрицательным выводом. Примерами таких устройств являются электролитические элементы для производства водорода, вакуумные трубки, электронно-лучевые трубки, осциллографы и элементы первичной батареи (включая все неперезаряжаемые батареи).
Однако, поскольку в силовом устройстве поток электронов реверсирован, анод является отрицательным выводом. Примерами таких устройств являются электролитические элементы для производства водорода, вакуумные трубки, электронно-лучевые трубки, осциллографы и элементы первичной батареи (включая все неперезаряжаемые батареи).
Другими словами, как пользователи различают вашу батарею?
Это действительно очень просто. На каждом конце большинства аккумуляторов для жилых автофургонов, автомобилей и даже бытовых аккумуляторов есть знак плюс (+) и минус (-). Знак минус относится к аноду, поскольку он является отрицательным электродом (и, следовательно, теряет электроны). Знак плюс, с другой стороны, относится к катоду, потому что он является положительным электродом (и, таким образом, получает электроны).
Почему важно понимать разницу между анодом и катодом в батарее?
Понимание разницы между анодом и катодом важно, потому что оно позволяет вам точно понять, как работают ваши батареи, независимо от того, находитесь ли вы на лодке, водите транспортное средство для отдыха или просто меняете батареи в пульте дистанционного управления. Вы будете уверены в том, что правильно установите источник питания вашего устройства, независимо от того, устанавливаете ли вы собственную солнечную установку или заменяете батареи.
Вы будете уверены в том, что правильно установите источник питания вашего устройства, независимо от того, устанавливаете ли вы собственную солнечную установку или заменяете батареи.
Это также полезно для запуска автомобиля от внешнего источника. Вы когда-нибудь застревали, пытаясь понять, куда поставить зажимы кабеля усилителя? Теперь вы понимаете, что один идет на отрицательный конец (анод), а другой идет только на положительный конец (катод)
Использование
- Отрицательный или восстановительный проводник, который высвобождает электроны во внешнюю цепь и окисляется в ходе химической реакции, известен как заряд анода.
- Положительный или окислительный проводник, который получает электроны из внешней цепи и опускается во время химической реакции, называется катодом.
- Под электролитами обычно понимают жидкости, такие как вода или различные растворители, с растворенными солями, кислотами или щелочами, необходимыми для ионной проводимости.
 Следует отметить, однако, что несколько аккумуляторов, помимо стандартных.
Следует отметить, однако, что несколько аккумуляторов, помимо стандартных.
Заключение
Отрицательный или восстановительный электрод, который испускает электроны во внешнюю цепь и окисляется во время электрохимической реакции, известен как анод.
Катод — это положительный или окислительный электрод, который забирает электроны из внешней цепи и восстанавливает их в ходе электрохимической реакции.
Как работает батарея?
Энергия не может быть создана или уничтожена, но ее можно сохранить в различных формах. Один из способов его хранения — в виде химической энергии в батарее. При подключении к цепи батарея может производить электричество.
Батареи преобразуют химическую энергию в электрическую |
Батарея имеет два вывода: положительный (катод) и отрицательный (анод). Если вы соедините две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
В батарее происходит химическая реакция
Простой пример. Батарейка с лимонными ячейками
Начнем с очень простой батарейки, в которой используется лимон, в который, например, вставлены два разных металлических предмета. оцинкованный гвоздь и медная монета или проволока. Медь служит положительным электродом или катодом, а оцинкованный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая создает небольшую разность потенциалов.
Поскольку атомы меди (Cu) притягивают электроны больше, чем атомы цинка (Zn), если вы поместите кусок меди и кусок цинка в контакт друг с другом, электроны перейдут от цинка к меди. Когда электроны концентрируются на меди, они будут отталкиваться друг от друга и останавливать поток электронов от цинка к меди. С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь по проводу.
ЛИМОННАЯ БАТАРЕЯ | Как работает лимонная батарейка? Лимонная батарея состоит из лимона и двух металлических электродов из разных металлов, таких как медная монета или проволока, и оцинкованного (оцинкованного) гвоздя. Энергия для батареи поступает не от лимона, а от химического превращения цинка (или другого металла). Если предположить, что используются цинковые и медные электроды (например, медная монета и оцинкованный гвоздь), то один лимон может генерировать примерно 0,9 Вольт. Слева последовательная цепь лимонов показывает, что вырабатывается 3,41 вольта. ПРИМЕЧАНИЕ: Можно использовать картофель, яблоки, квашеную капусту или любые другие фрукты или овощи, содержащие кислоту или другой электролит, но лимоны предпочтительнее из-за их более высокой кислотности. Например, в картофеле электролитом является фосфорная кислота, а в лимонах — лимонная кислота. |
В лимонной батарее происходит как окисление (потеря электронов), так и восстановление (приобретение электронов). Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Zn —> Zn2 + + 2 e-
На медном катоде ионы водорода (сольватированные протоны из кислого раствора в лимоне) восстанавливаются с образованием молекулярного водорода:
2H++ 2e- —> h3
Что заставляет электроны двигаться?
Когда вы отпускаете мяч, который держите в руках, он падает на землю, потому что гравитационное поле Земли тянет мяч вниз. Точно так же заряженные частицы, такие как электроны, должны совершить работу, чтобы переместиться из одной точки в другую. Количество работы на единицу заряда называется разностью электрических потенциалов между двумя точками. Единица разности потенциалов называется вольт.
Разность потенциалов между катодом и анодом определяется химической реакцией. Внутри батареи электроны подталкиваются химической реакцией к положительному концу, создавая разность потенциалов.
Именно эта разность потенциалов заставляет электроны двигаться по проводу.
Разность потенциалов может быть положительной или отрицательной, подобно гравитационной энергии, движущейся вверх или вниз по склону. В батарее поток электронов направлен вниз… электроны могут течь вверх, как в случае с зарядным устройством.
Почему внутри батареи электроны не перемещаются от анода к катоду?
Электролит в батарее не дает одиноким электронам двигаться прямо от анода к катоду внутри батареи. Когда клеммы соединены токопроводящим проводом, электроны могут легко течь от анода к катоду.
В каком направлении движутся электроны в проводе?
Электроны заряжены отрицательно, поэтому они будут притягиваться к положительному концу батареи и отталкиваться от отрицательного конца. Когда батарея подключена к устройству, которое позволяет электронам течь через нее, они текут от отрицательного (анодного) к положительному (катодному) выводу.
Кто изобрел гальванический элемент (батарейку)?
ПЕРВАЯ БАТАРЕЯ VOLTA | Аккумулятор производства Volta считается первым гальваническим элементом. Теперь у нас есть две клеммы, и если мы их соединим, потечет ток. Реакции в этой ячейке следующие: цинк Zn —> Zn2+ + 2e- серная кислота 2H+ + 2e- —> h3 Медь не вступает в реакцию, действуя как электрод для химической реакции. |
Как работает современный аккумулятор (угольно-цинковый аккумулятор)?
Сухой угольно-цинковый элемент или батарея упакованы в цинковую банку, которая служит как контейнером, так и отрицательной клеммой (анодом). Цинк окисляется в соответствии со следующим полууравнением. Диоксид марганца смешивают с угольным порошком для увеличения электропроводности. Реакция выглядит следующим образом: 2MnO2(т) + 2 e- + 2Nh5Cl(водн.) —> , а CL сочетается с Zn2+. В этой полуреакции марганец восстанавливается из степени окисления (+4) в (+3). Zn(т) + 2MnO2(т) + 2Nh5Cl(водн.) —> Mn2O3(т) + Zn(Nh4)2Cl2 (водн.) + h3O(ж) Аккумулятор имеет Э.Д.С. около 1,5 В. |
Какие существуют типы батарей?
В разных типах батарей используются разные типы химикатов и химических реакций. Некоторые из наиболее распространенных типов батарей:
Щелочные батареи | Используется в батареях Duracell® и Energizer® и других щелочных батареях. Электроды цинково-марганцево-оксидные. Электролит представляет собой щелочную пасту. |
Свинцово-кислотный аккумулятор | Используются в автомобилях. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. |
Литиевая батарея | Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литиевая батарея | Эти батарейки используются в фотоаппаратах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литий-ионный аккумулятор | Эти батареи используются в портативных компьютерах, сотовых телефонах и другом портативном оборудовании с интенсивным использованием. |
| Никель-кадмиевая или никель-кадмиевая батарея | Электроды никель-гидроксидно-кадмиевые. Электролит – гидроксид калия. |
| Цинк-угольная батарея или стандартная угольная батарея – | Цинк и углерод используются во всех обычных или стандартных сухих батареях AA, C и D. Электроды изготовлены из цинка и углерода, а паста из кислотных материалов между ними служит электролитом. |
ССЫЛКИ И ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Potato Power: Руководство для учителя
История батареи
Электрохимические реакции
Углеродно-цинковая батарея в цинковой батарее
?
Как работают батареи Анимированное руководство по науке о батареях
Оценка
Вопросы:
М несколько
Выбор вопросов
1. В
В
аккумулятор плюсовая клемма называется:
а) анод
б) катод
в) электролит
г) провод
2.
Что заставляет электроны течь по проводу:
а) гравитационный потенциал выталкивает электроны через провод
б) кислоты проталкивают электроны по проводу
в) разность потенциалов между анодом и катодом толкает электроны
по проводу
г) электроны текут не по проводу, а по электролиту
3.
Какое утверждение о лимонной батарейке верно?
а) Энергия для батареи исходит не от лимона, а
скорее химическое изменение цинка (или другого металла)
б) Батарея состоит из двух металлических электродов разной
металлы, такие как медная монета или проволока и оцинкованный гвоздь.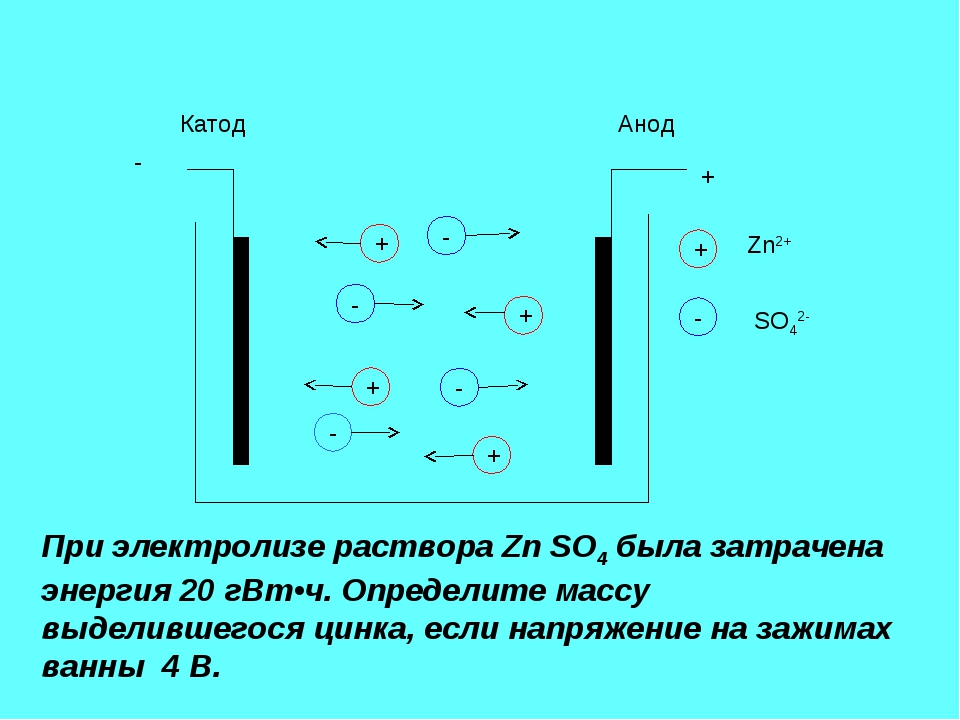
 Следует отметить, однако, что несколько аккумуляторов, помимо стандартных.
Следует отметить, однако, что несколько аккумуляторов, помимо стандартных.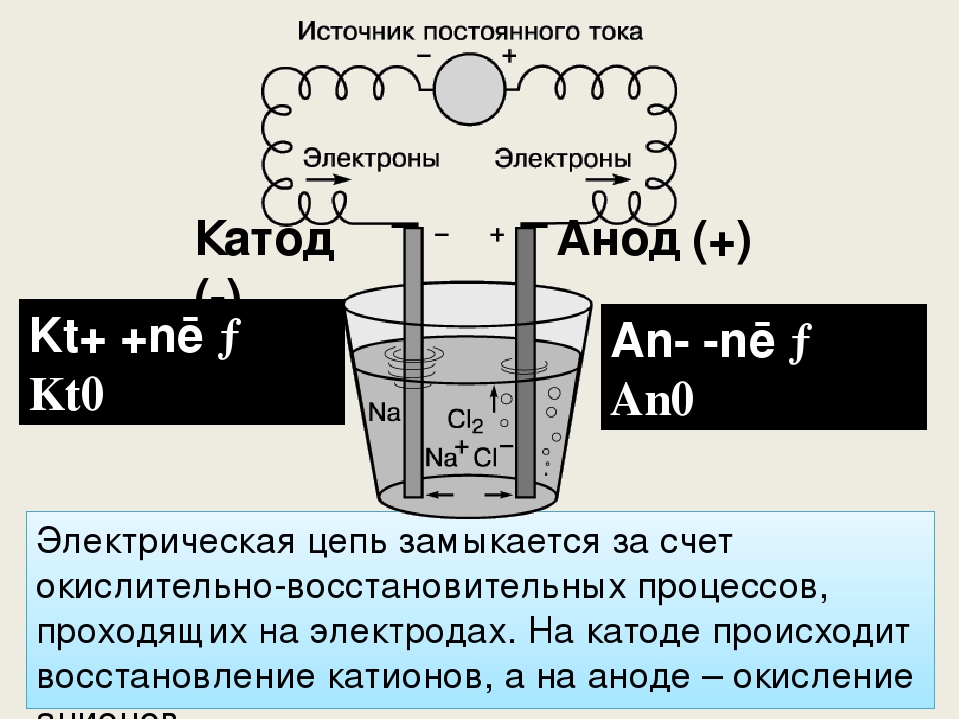 Цинк окисляется внутри лимона, обменивая часть своих электронов, чтобы достичь более низкого энергетического состояния, а высвобождаемая энергия обеспечивает энергию. Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе.
Цинк окисляется внутри лимона, обменивая часть своих электронов, чтобы достичь более низкого энергетического состояния, а высвобождаемая энергия обеспечивает энергию. Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе. Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом.
Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом.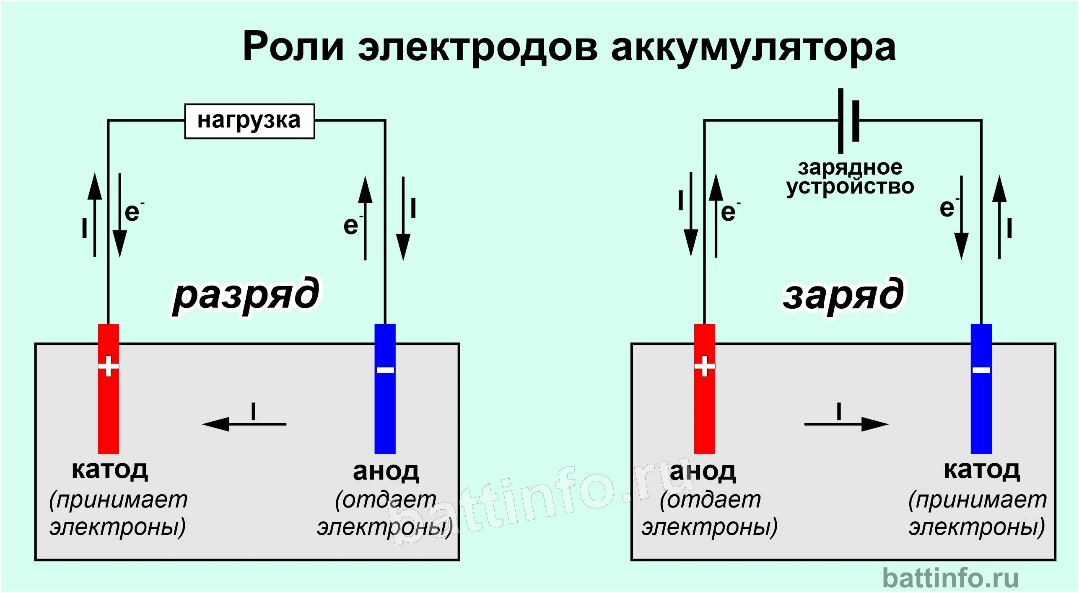 Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли.
Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли. Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как:
Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как: