Содержание
Элюотропный ряд растворителей (для SiO2 и Al2O3)
- Подробности
- Опубликовано 14 Сентябрь 2013
- Автор: Administrator
В приведенной ниже таблице расположены вначале слабо полярные растворители, и в конце — сильно полярные.
Ряд растворителей по Шталю
|
Ряд растворителей по Траппу
|
| Гексан | |
| Гептан | Петролейный эфир |
| Циклогексан | Циклогексан |
| Дисульфид углерода | |
| Четыреххлористый углерод | Четыреххлористый углерод |
| Дихлорэтилен | |
| Бензол | Бензол |
| Толуол | |
| Хлороформ | |
| Диэтиловый эфир | Диэтиловый эфир |
| Тетрагидрофуран | |
| Хлороформ | |
| Этилацетат | Этилацетат |
| Пиридин | |
| Ацетон | Ацетон |
| Метилэтилкетон | |
| н-Бутанол | |
| Этанол | Этанол |
| Метанол | Метанол |
| Формамид | |
| Вода | Вода |
| Уксусная кислота | |
| Пиридин |
Литература:
- Набиванец Б.
 И. Хроматографический анализ. 1979. 264 с
И. Хроматографический анализ. 1979. 264 с - Беккер X.N. Органикум. Часть 1. 1992. 488 с
В приведенной ниже таблице расположены вначале слабо полярные растворители, и в конце — сильно полярные.
Растворитель
|
| Фторалканы |
| н-Пентан |
| н-Гексан |
| н-Гептан |
| Изооктан |
| Циклогексан |
| Четыреххлористый углерод |
| Диизопропиловый эфир |
| Толуол |
| н-Пропилхлорид |
| Бензол |
| Этилбромид |
| Этиловый эфир |
| Хлороформ |
| Метилен хлорид |
| Тетрагидрофуран |
| Этиленхлорид |
| Метилэтилкетон |
| Ацетон |
| Диоксан |
| Этилацетат |
| Метилацетат |
| Нитрометан |
| Ацетонитрил |
| Пиридин |
| н-Пропанол |
| Этанол |
| Метанол |
| Гликоль |
| Вода |
| Формамид |
| Уксусная кислота |
Литература:
- Соколова В.
 И. Жидкостная хроматография нефтепродуктов. 1984. 144 с
И. Жидкостная хроматография нефтепродуктов. 1984. 144 с
Виды электродов таблица — краткое описание, применение
Электроды описание — виды электродов, применение, характеристики
Для удобства предлагаем для клиентов описание видов электродов. В таблице Вы найдете все электроды, которые производятся на заводе сварочных электродов ООО Ватра. У нас Вы можете купить электроды оптом и в розницу по самым низким ценам.
Купить электроды в розницу можно в фирменных магазинах «Эксперт — все для сварки и стройки», по РБ в филиалах (Барановичи, Брест, Витебск, Гомель, Гродно, Могилев, Полоцк, Солигорск и др.) и у партнеров в РФ.
Электроды сварочные собственного производства
|
||||
|
Марка электрода |
Тип Электрода по ГОСТ 9467-45 Гост 9466-75 |
Диаметр, мм |
Род сварочного тока |
Назначение |
|
Электроды для сварки углеродистых сталей рядовых и ответственных конструкций
|
||||
|
МР-3 |
Э46 |
2.  5; 3.0; 4.0 5; 3.0; 4.0
|
Переменный и постоянный обратной полярности |
Рутиловое покрытие. Электроды предназначены для сварки черных металлов. Область применения- строительство и машиностроение. Электроды позволяют выполнять сварку на низких токах, а для электродов малого диаметра-от источников питания, включенных в бытовую сеть. Обеспечивают легкое отделение шлака и хорошее повторное зажигание, равномерное горение дуги в процессе сварки. |
|
ОЗС-12 |
Э46 |
2.5; 3.0; 4.0 |
Переменный и постоянный прямой и обратной полярности |
|
|
АНО-21 |
Э46 |
2.5; 3.0; 4.0 |
Постоянный ток любой полярности, переменный от трансформатора с напряжением холостого хода не менее 50В |
Для сварки конструкций из низкоуглеродистых сталей малых толщин марок Ст3, 10, 20 и др.  Электроды обеспечивают легкое зажигание дуги, мелкочешуйчатое формирование металла шва, легкую или самопроизвольную отделяемость шлаковой корки. Они могут применяться для сварки водопроводных труб, газопроводов малого давления. Электроды обеспечивают легкое зажигание дуги, мелкочешуйчатое формирование металла шва, легкую или самопроизвольную отделяемость шлаковой корки. Они могут применяться для сварки водопроводных труб, газопроводов малого давления.
|
|
АНО-36 |
Э46 |
2.5; 3.0; 4.0 |
Переменный и постоянный обратной полярности |
Рутил-целллюлозное покрытие. Предназначены для сварки рядовых и ответственных конструкций из углеродистых сталей, во всех пространственных положениях шва. Также используется для сварки потолочных и вертикальных швов. Для сварки черных металлов. |
|
Электроды для сварки углеродистых сталей особо ответственных конструкций
|
||||
|
УОНИ 13/55 |
Э50А |
2.5; 3.0; 4.0 |
Постоянный ток обратной полярности |
Для сварки ответственных конструкций из углеродистых и низколегированных сталей, когда к металлу сварных швов предъявляются повышенные требования по пластичности, ударной вязкости.  Сварка во всех пространственных положениях, кроме вертикального. Свариваемая поверхность должна быть тщательно очищена от окисов, ржавчины, жиров, влаги, краски и других загрязнений. Сварка во всех пространственных положениях, кроме вертикального. Свариваемая поверхность должна быть тщательно очищена от окисов, ржавчины, жиров, влаги, краски и других загрязнений.
|
|
УОНИ 13/45 |
Э42А |
2.5; 3.0; 4.0 |
Постоянный ток обратной полярности |
|
|
ТМУ-21У |
Э50А |
2.5; 3.0; 4.0 |
Постоянный ток обратной полярности |
|
|
Электроды наплавочные
|
||||
|
Т-590 |
Э-120Х6С2ГР3 |
2.5; 3.0; 4.0 |
Постоянный ток обратной полярности |
Предназначены для наплавки деталей из стали |
|
ЭН-60 |
Э-70Х3СМТ |
2.  5; 3.0; 4.0 5; 3.0; 4.0
|
Постоянный ток обратной полярности |
|
|
Электроды для сварки серого, высокопрочного и ковкого чугуна
|
||||
|
ЦЧ-4В |
ГОСТ 9466-75 |
3.0; 4.0; 5.0 |
Постоянный ток обратной полярности |
Предназначены для холодной сварки или заварки деталей из высокопрочного чугуна. |
|
МНЧ-2 |
ГОСТ 9466-75 |
3.0; 4.0; 5.0 |
Постоянный ток обратной полярности |
|
|
Электроды для сварки изделий из коррозионностойких хромоникелевых сталей (электроды для нержавейки)
|
||||
|
ЦЛ-11 |
Э-08Х20Н9Г2Б |
3.  0; 4.0; 5.0 0; 4.0; 5.0
|
Постоянный ток обратной полярности |
Электроды используются для сварки коррозионно- стойких нержавеющих сталей. Сварка во всех пространственных положениях. |
|
ОЗЛ-8 |
Э-07Х20Н9 |
3.0; 4.0; 5.0 |
Постоянный ток обратной полярности |
|
|
НЖ-13 |
Э-09Х19Н10Г2М2Б |
3.0; 4.0; 5.0 |
Постоянный ток обратной полярности |
|
|
Электроды для сварки разнородных сталей (нержавейка+сталь)
|
||||
|
ОЗЛ-6 |
Э-10Х25Н13Г2 |
3.0; 4.0 |
Постоянный ток обратной полярности |
Данные электроды используются для сварки разнородных жаропростойких сталей.  Сварка во всех пространственных положениях. Сварка во всех пространственных положениях.
|
|
ОЗЛ-9А |
Э-28Х24Н16Г6 |
3.0; 4.0 |
Постоянный ток обратной полярности |
|
|
ОЗЛ-17У |
ГОСТ 9466-75 |
3.0; 4.0 |
Постоянный ток обратной полярности |
|
|
ОЗЛ-25Б |
Э-10Х20Н70Г2М2Б2В |
3.0; 4.0 |
Постоянный ток обратной полярности |
|
|
ЦТ-15 |
Э-08Х19Н10Г2Б |
3.0; 4.0 |
Постоянный ток обратной полярности |
|
|
ЭА-395/9 |
Э-11Х15Н25М6АГ2 |
3.0; 4.0 |
Постоянный ток обратной полярности |
|
|
ЭА-400/10У |
Э-07Х19Н11МГ2Ф |
3.  0; 4.0 0; 4.0
|
Постоянный ток обратной полярности |
|
Значения взяты с http://www.bandj.com/BJProduct/SolProperties/Polarity.html Составитель А. Чандрасекаран |
6.1: Электроотрицательность и полярность — Химия LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 112692
Развитие навыков
- Определение электроотрицательности и оценка полярности ковалентных связей
youtube.com/embed/PVL24HAesnc?start=000&end=202&vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
Видео \(\PageIndex{1}\): Предварительный просмотр роли электроотрицательности в молекулярной полярности.
Обзор электроотрицательности
Является ли связь неполярной или полярной ковалентной, определяется свойством связывающих атомов, называемым электроотрицательностью. Электроотрицательность — это мера тенденции атома притягивать к себе электроны (или плотность электронов). Он определяет, как общие электроны распределяются между двумя атомами в связи. Чем сильнее атом притягивает электроны своих связей, тем больше его электроотрицательность. Электроны в полярной ковалентной связи смещаются в сторону более электроотрицательного атома; таким образом, более электроотрицательным является атом с частичным отрицательным зарядом. Чем больше разница в электроотрицательности, тем более поляризовано распределение электронов и тем больше парциальные заряды атомов.
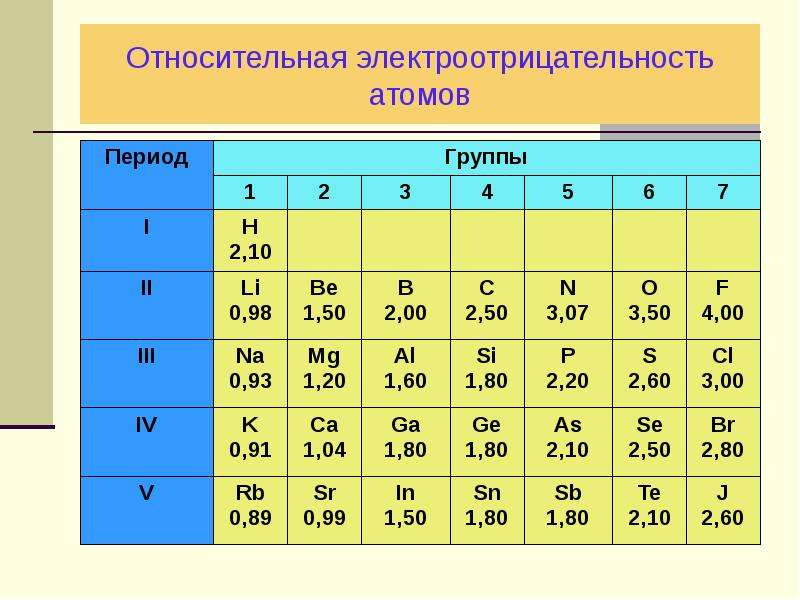
На рисунке \(\PageIndex{1}\) показаны значения электроотрицательности элементов, предложенные одним из самых известных химиков двадцатого века Линусом Полингом. Как правило, электроотрицательность увеличивается слева направо по периоду в периодической таблице и уменьшается по группе. Таким образом, неметаллы, расположенные вверху справа, обычно имеют самую высокую электроотрицательность, причем фтор является самым электроотрицательным элементом из всех (EN = 4,0). Металлы, как правило, менее электроотрицательны, а металлы группы 1 имеют самую низкую электроотрицательность. Обратите внимание, что благородные газы исключены из этого рисунка, потому что эти атомы обычно не делят электроны с другими атомами, поскольку они имеют полную валентную оболочку. (Хотя соединения благородных газов, такие как XeO 2 существуют, они могут образовываться только в экстремальных условиях и поэтому не вписываются в общую модель электроотрицательности.)
значения, полученные Полингом, следуют предсказуемым периодическим тенденциям с более высокой электроотрицательностью в верхнем правом углу периодической таблицы.
Лайнус Полинг
Лайнус Полинг — единственный человек, получивший две неразделенные (индивидуальные) Нобелевские премии: одну по химии в 1954 за его работу о природе химических связей и один за мир в 1962 году за его противодействие оружию массового уничтожения. Он разработал множество теорий и концепций, лежащих в основе нашего нынешнего понимания химии, включая электроотрицательность и резонансные структуры.
Лайнус Полинг (1901–1994) внес важный вклад в область химии. Он также был видным активистом, освещавшим вопросы, связанные со здоровьем и ядерным оружием.
Полинг также внес свой вклад во многие другие области, помимо химии. Его исследования серповидноклеточной анемии выявили причину заболевания — наличие генетически унаследованного аномального белка в крови — и проложили путь для области молекулярной генетики. Его работа также сыграла ключевую роль в сдерживании испытаний ядерного оружия; он доказал, что радиоактивные осадки в результате ядерных испытаний представляют опасность для здоровья населения.
Электроотрицательность и сродство к электрону
Мы должны быть осторожны, чтобы не путать электроотрицательность и сродство к электрону. Сродство элемента к электрону — измеримая физическая величина, а именно энергия, выделяющаяся или поглощаемая при присоединении электрона изолированным атомом газовой фазы, измеряемая в кДж/моль. С другой стороны, электроотрицательность описывает, насколько сильно атом притягивает электроны в связи. Это безразмерная величина, которая рассчитывается, а не измеряется. Полинг получил первые значения электроотрицательности, сравнив количество энергии, необходимое для разрыва различных типов связей. Он выбрал произвольную относительную шкалу от 0 до 4,9.0482
Электроотрицательность и тип связи
Абсолютное значение разности электроотрицательностей (ΔEN) двух связанных атомов обеспечивает приблизительную меру ожидаемой полярности связи и, следовательно, типа связи. Когда разница очень мала или равна нулю, связь является ковалентной и неполярной. Когда он большой, связь является полярной ковалентной или ионной. Абсолютные значения разностей электроотрицательностей между атомами в связях H–H, H–Cl и Na–Cl равны 0 (неполярные), 0,9 (полярные ковалентные) и 2,1 (ионные) соответственно. Степень, в которой электроны разделены между атомами, варьируется от полностью равного (чистая ковалентная связь) до полного отсутствия (ионная связь). На рисунке \(\PageIndex{2}\) показана зависимость между разницей электроотрицательностей и типом связи.
Когда он большой, связь является полярной ковалентной или ионной. Абсолютные значения разностей электроотрицательностей между атомами в связях H–H, H–Cl и Na–Cl равны 0 (неполярные), 0,9 (полярные ковалентные) и 2,1 (ионные) соответственно. Степень, в которой электроны разделены между атомами, варьируется от полностью равного (чистая ковалентная связь) до полного отсутствия (ионная связь). На рисунке \(\PageIndex{2}\) показана зависимость между разницей электроотрицательностей и типом связи.
Рисунок \(\PageIndex{2}\): По мере увеличения разницы электроотрицательностей между двумя атомами связь становится более ионной.
На рисунке \(\PageIndex{4}\) показана грубая аппроксимация различий электроотрицательности, связанных с ковалентными, полярными ковалентными и ионными связями. Однако эта таблица является лишь общим руководством со многими исключениями. Например, атомы H и F в HF имеют разность электроотрицательностей 1,9, а атомы N и H в NH 3 разница составляет 0,9, однако оба этих соединения образуют связи, которые считаются полярными ковалентными. Точно так же атомы Na и Cl в NaCl имеют разность электроотрицательностей 2,1, а атомы Mn и I в MnI 2 имеют разность 1,0, однако оба эти вещества образуют ионные соединения.
Точно так же атомы Na и Cl в NaCl имеют разность электроотрицательностей 2,1, а атомы Mn и I в MnI 2 имеют разность 1,0, однако оба эти вещества образуют ионные соединения.
Лучшее руководство по ковалентному или ионному характеру связи состоит в том, чтобы рассмотреть типы вовлеченных атомов и их относительное положение в периодической таблице. Связи между двумя неметаллами обычно ковалентны; связь между металлом и неметаллом часто ионная.
Некоторые соединения содержат как ковалентные, так и ионные связи. Атомы в многоатомных ионах, таких как OH – , \(\ce{NO3-}\) и \(\ce{Nh5+}\), удерживаются вместе полярными ковалентными связями. Однако эти многоатомные ионы образуют ионные соединения, соединяясь с ионами противоположного заряда. Например, нитрат калия KNO 3 содержит катион K + и многоатомный анион \(\ce{NO3-}\). Таким образом, связь в нитрате калия ионная, возникающая в результате электростатического притяжения между ионами K + и \(\ce{NO3-}\), а также ковалентная между атомами азота и кислорода в \(\ce{NO3-}\).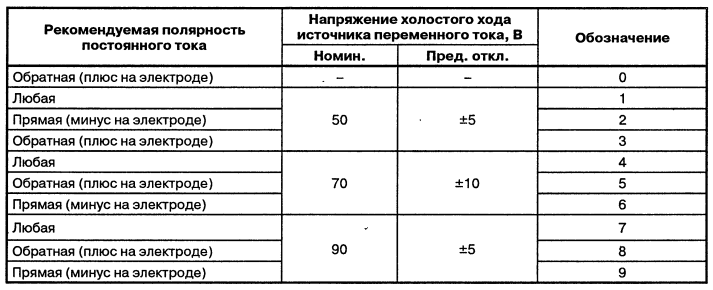
Пример \(\PageIndex{1}\): электроотрицательность и полярность связи
Полярность связи играет важную роль в определении структуры белков. Используя значения электроотрицательности в Рисунок \(\PageIndex{1}\) , расположите следующие ковалентные связи — все они обычно встречаются в аминокислотах — в порядке возрастания полярности. Затем обозначьте положительные и отрицательные атомы, используя символы δ+ и δ–:
C–H, C–N, C–O, N–H, O–H, S–H
Раствор
Полярность этих связей возрастает по мере увеличения абсолютного значения разности электроотрицательностей. Атом с обозначением δ- является более электроотрицательным из двух. В таблице \(\PageIndex{1}\) эти связи показаны в порядке возрастания полярности.
 «>
«>
Упражнение \(\PageIndex{1}\)
Силиконы представляют собой полимерные соединения, содержащие, среди прочего, следующие типы ковалентных связей: Si–O, Si–C, C–H и C–C. Используя значения электроотрицательности на рисунке \(\PageIndex{3}\), расположите связи в порядке возрастания полярности и обозначьте положительные и отрицательные атомы, используя символы δ+ и δ–.
Используя значения электроотрицательности на рисунке \(\PageIndex{3}\), расположите связи в порядке возрастания полярности и обозначьте положительные и отрицательные атомы, используя символы δ+ и δ–.
Ответить
Узнать больше
youtube.com/embed/ASLUY2U1M-8?vq=hd1080″ frameborder=»0″ allowfullscreen=»true»>
Видео \(\PageIndex{2}\): Вода — уникальная полярная молекула.
Резюме
Видео \(\PageIndex{3}\): Обзор электроотрицательности.
Ковалентные связи образуются, когда электроны распределяются между атомами и притягиваются ядрами обоих атомов. В чисто ковалентных связях электроны распределены поровну. В полярных ковалентных связях электроны распределяются неравномерно, поскольку один атом оказывает на электроны более сильное притяжение, чем другой. Способность атома притягивать пару электронов в химической связи называется его электроотрицательностью. Разница в электроотрицательности между двумя атомами определяет, насколько полярной будет связь. В двухатомной молекуле с двумя одинаковыми атомами нет разницы в электроотрицательности, поэтому связь неполярная или чисто ковалентная. Когда разница электроотрицательностей очень велика, как в случае между металлами и неметаллами, связь характеризуется как ионная.
В двухатомной молекуле с двумя одинаковыми атомами нет разницы в электроотрицательности, поэтому связь неполярная или чисто ковалентная. Когда разница электроотрицательностей очень велика, как в случае между металлами и неметаллами, связь характеризуется как ионная.
Глоссарий
- длина связи
- расстояние между ядрами двух связанных атомов, при котором достигается наименьшая потенциальная энергия
- ковалентная связь
- образуется, когда электроны делятся между атомами
Связь
- электроотрицательность
- склонность атома притягивать к себе электроны в связи
- полярная ковалентная связь
- ковалентная связь между атомами различной электроотрицательности; ковалентная связь с положительным концом и отрицательным концом
- чистая ковалентная связь
- (также неполярная ковалентная связь) ковалентная связь между атомами с одинаковой электроотрицательностью
Авторы
-
Пол Флауэрс (Университет Северной Каролины, Пембрук), Клаус Теопольд (Университет Делавэра) и Ричард Лэнгли (Государственный университет Стивена Ф.
 Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]).
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…[email protected]). - Аделаида Кларк, Орегонский технологический институт
- Ускоренный курс Химия: Ускоренный курс является подразделением компании Complexly, и видео можно бесплатно транслировать в образовательных целях.
- Приверженность TED-Ed созданию уроков, которыми стоит поделиться, является продолжением миссии TED по распространению великих идей. В растущей библиотеке TED-Ed анимаций TED-Ed вы найдете тщательно отобранные образовательные видеоролики, многие из которых представляют собой совместные работы талантливых педагогов и аниматоров, номинированных на веб-сайте TED-Ed.
- Питомец учителя
Обратная связь
Хотите оставить отзыв об этом тексте? Кликните сюда.
Нашли опечатку и хотите получить дополнительные баллы? Кликните сюда.
 И. Хроматографический анализ. 1979. 264 с
И. Хроматографический анализ. 1979. 264 с И. Жидкостная хроматография нефтепродуктов. 1984. 144 с
И. Жидкостная хроматография нефтепродуктов. 1984. 144 с 1
1  1
1  1
1  Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…
Остина) с соавторами. Контент учебника, созданный OpenStax College, находится под лицензией Creative Commons Attribution License 4.0. Скачать бесплатно на http://cnx.org/contents/85abf193-2бд…