Содержание
Принцип работы радиатора/батареи отопления
Как работает радиатор отопления?
Отопительный радиатор стоит в каждом доме, однако далеко не все пользователи знают, как работают такие системы. Между тем знать об этом важно, чтобы выбрать оптимальную для своей квартиры батарею.
Общие принципы работы отопительных радиаторов
Подходы к отоплению в системах отличаются, но есть общие принципы, по которым работают все радиаторы:
- В систему подается теплоноситель, чаще всего им служит горячая вода.
- Теплоноситель нагревает поверхность радиатора.
- Нагретая батарея передает тепло в пространство помещения.
- Постепенно теплоноситель остывает, после чего перетекает в общую систему, где проходит повторный нагрев.
Это упрощенный принцип работы, схема распределения тепла в различных радиаторах будет отличаться.
Как работают батареи из чугуна
При подключении радиаторов, изготовленных из чугуна, наиболее часто используется односторонняя схема. То есть нагретая вода подается и возвращается в общую систему с одной стороны. Выглядит это так:
То есть нагретая вода подается и возвращается в общую систему с одной стороны. Выглядит это так:
- Нагретая вода подается в радиатор.
- Вода остывает, благодаря физическим процессам перетекая по конструкции батареи.
- Теплоноситель вытекает в другую трубу, попадает обратно в общую систему.
Это наиболее простая схема. Для существенного нагрева и поддержания оптимальной температуры требуется значительный объем теплоносителя. Однако такие радиаторы медленнее остывают, способны долго сохранять тепло даже при экстренном отключении отопления. Также чугун нетребователен к качеству теплоносителя, однако не способен выдерживать сильные гидроудары, которые нередко случаются в центральных системах отопления.
Как работают батареи из стали, алюминия и биметаллические модели
Данные радиаторы могут подключаться по различным схемам, а работа их также основана на передаче тепла в окружающее пространство. В отличие от чугунных, такие типы батарей требуют минимум теплоносителя (примерно 350 г), что не только упрощает монтаж и демонтаж, но и делает их экономичными.
В отличие от чугунных, такие типы батарей требуют минимум теплоносителя (примерно 350 г), что не только упрощает монтаж и демонтаж, но и делает их экономичными.
Экономия теплоносителя происходит за счет тонкой трубки, по которой течет вода. При этом площадь соприкосновения с воздухом остается значительной, потому радиаторы из стали, алюминия или совокупности этих металлов отличаются лучшей теплоотдачей.
Примечательно, что биметаллические радиаторы характеризуются более высоким коэффициентом теплоотдачи. Высокие показатели достигаются благодаря их устройству: теплоноситель перетекает по стальному сердечнику, который передает тепло алюминиевой оболочке (оболочка не контактирует с водой, потому защищена от коррозии).
Как работают вакуумные радиаторы
Нагрев при помощи вакуумной батареи отличается от всех озвученных выше типов, поскольку здесь используется принцип двойной теплопередачи.
Используемая в роли теплоносителя вода проходит наиболее короткий путь (по запаянной прямой трубе), что обеспечивает быстрый нагрев. С трубой контактирует жидкость внутри, которая и проводит тепло.
С трубой контактирует жидкость внутри, которая и проводит тепло.
Непосредственно батарея – это герметичные секции, в которых нет воздуха, что не позволяет жидкости внутри системы быстро остывать. Из-за отсутствия воздуха жидкость закипает при более низкой температуре. Работает радиатор по принципу:
- Теплоноситель нагревает жидкость внутри батареи вплоть до кипения.
- Пар заполняет собой внутреннюю конструкцию, оседает в виде конденсата на её стенках, после чего перетекает вниз.
- Цикл нагрева повторяется.
Поскольку батарея нагревается равномерно, теплоотдача вакуумных систем крайне велика, а используемый объем теплоносителя мал.
Читайте так же:
Отзывы — биметаллические радиаторы
Отзывы — алюминиевые радиаторы
Отзывы — радиаторы отопления
Принцип работы батарейки: Как образуется ток?
Главная » Устройство и производство
На чтение 2 мин Просмотров 750
Принцип работы батарейки заключается в простой химической реакции, которая происходит обычно между тремя элементами. В результате, реагирования веществ между собой, получается электрический ток. Это если говорить кратко.
В результате, реагирования веществ между собой, получается электрический ток. Это если говорить кратко.
Три ключевых объекта:
- Анод “+”
- Катод “-“
- Электролит
Анод или положительный полюс служит источником электронов. Обычно его изготавливают из цинка. Два электрода заставляет взаимодействовать между собой электролит. В качестве электролита выступает обычно соль, хлорид аммония или щелочь. Он может быть в сухом и жидком виде. Чтобы сделать густым это вещество производители добавляют полимерные соединения. Некоторые используют крахмал.
Ток поступает с положительного полюса на отрицательный. Это происходит если к батареи подключена нагрузка. Если просто соединить плюс и минус проводом произойдет замыкание. В результате этого может быстро сесть батарейка, а также произойти возгорание.
Катод играет роль восстановителя. Он приобретает электроны от анода. В электролитной среде ионы прекрасно передвигаются и способствуют хорошей выработке тока.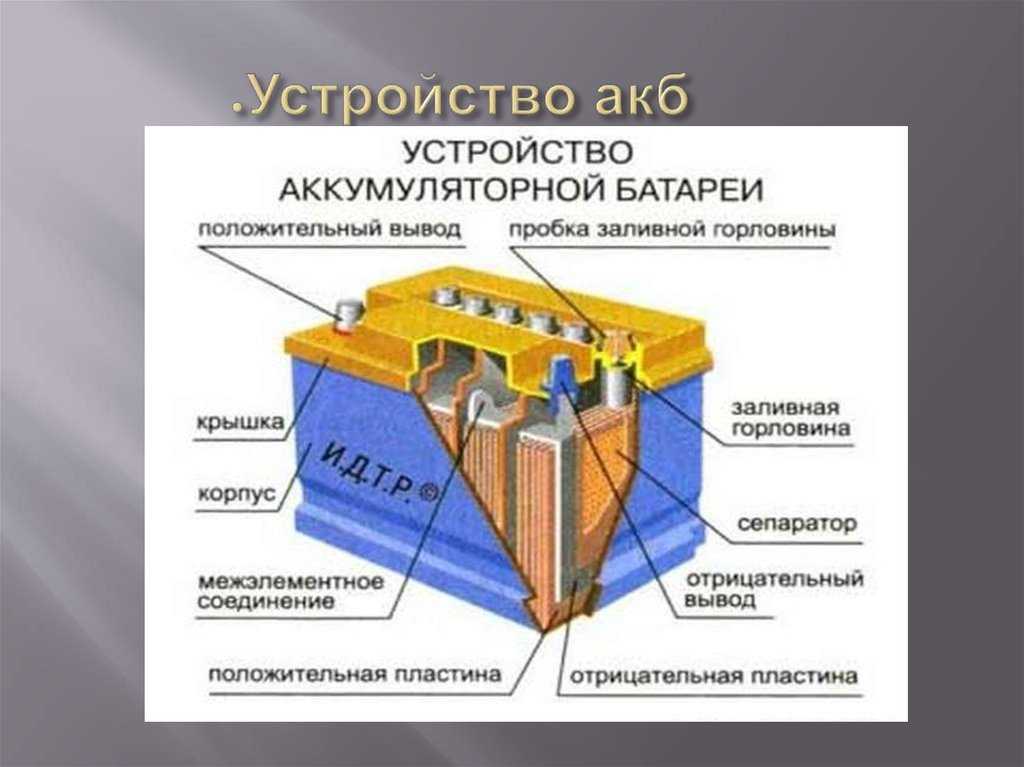
Что происходит с точки зрения химии?
К примеру, в стеклянную емкость нальем раствор серной кислоты и поместим туда стержень, выполненный из цинка. На поверхности данного стержня имеются положительно заряженные ионы. А вокруг этого цинкового объекта, в растворе, скапливаются отрицательные ионы вещества. У раствора имеются силы притяжения, которые с легкостью отрывают ионы цинка. В результате жидкость получает положительный заряд, а цинковая пластина или стержень отрицательный. Из физики известно, что разность потенциалов равна напряжению. Отсюда и возникает электрический ток.
В итоге, когда происходит контакт кислотного раствора и металла на границе образуется электрическое поле. В момент его появления химическая энергия превращается в электрическую. Таков принцип работы батареи.
Через некоторое время ресурс батареи будет истощен. Все зависит от того где и как используется источник питания. Например, если от него работает фонарик, то при умеренном использовании 2-х батарей на 1,5 вольта каждая, хватит на 1 месяц. Но если вставить эти же самые батарейки в электрическую машинку, она будет работать несколько часов.
Но если вставить эти же самые батарейки в электрическую машинку, она будет работать несколько часов.
В результате всего этого можно сделать вывод что чем больше нагрузка, тем быстрее разрядиться батарейка.
Читайте так же:
Устройство батарейки
Batareykaa.ru
window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-196’, blockId: ‘R-A-277958-196’ })})»+»ipt>»;
cachedBlocksArray[80628] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-191’, blockId: ‘R-A-277958-191’ })})»+»ipt>»;
cachedBlocksArray[80625] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-69’, blockId: ‘R-A-277958-69’ })})»+»ipt>»;
cachedBlocksArray[80615] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-48’, blockId: ‘R-A-277958-48’ })})»+»ipt>»;
cachedBlocksArray[80614] = «window.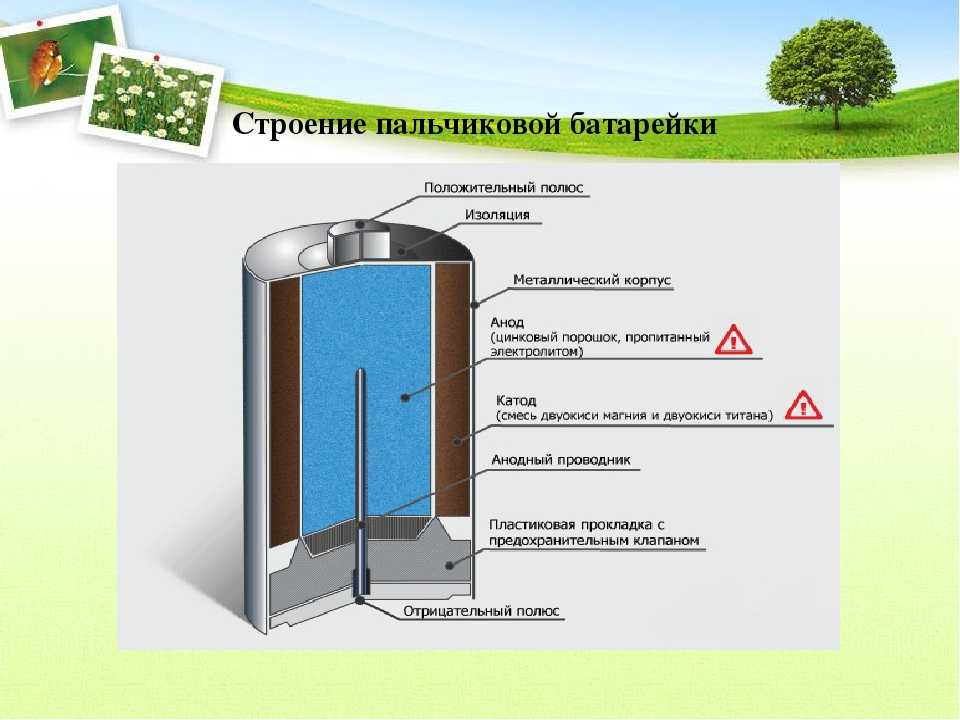 yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-44’, blockId: ‘R-A-277958-44’ })})»+»ipt>»;
yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-44’, blockId: ‘R-A-277958-44’ })})»+»ipt>»;
cachedBlocksArray[80613] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-40’, blockId: ‘R-A-277958-40’ })})»+»ipt>»;
cachedBlocksArray[80612] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-36’, blockId: ‘R-A-277958-36’ })})»+»ipt>»;
cachedBlocksArray[80611] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-35’, blockId: ‘R-A-277958-35’ })})»+»ipt>»;
cachedBlocksArray[80610] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277958-30’, blockId: ‘R-A-277958-30’ })})»+»ipt>»;
cachedBlocksArray[284597] = «window.yaContextCb.push(()=>{ Ya.Context.AdvManager.render({ renderTo: ‘yandex_rtb_R-A-277959-6’, blockId: ‘R-A-277959-6’ })})»+»ipt>»;
Как работает батарея — Любопытно
Представьте себе мир без батареек.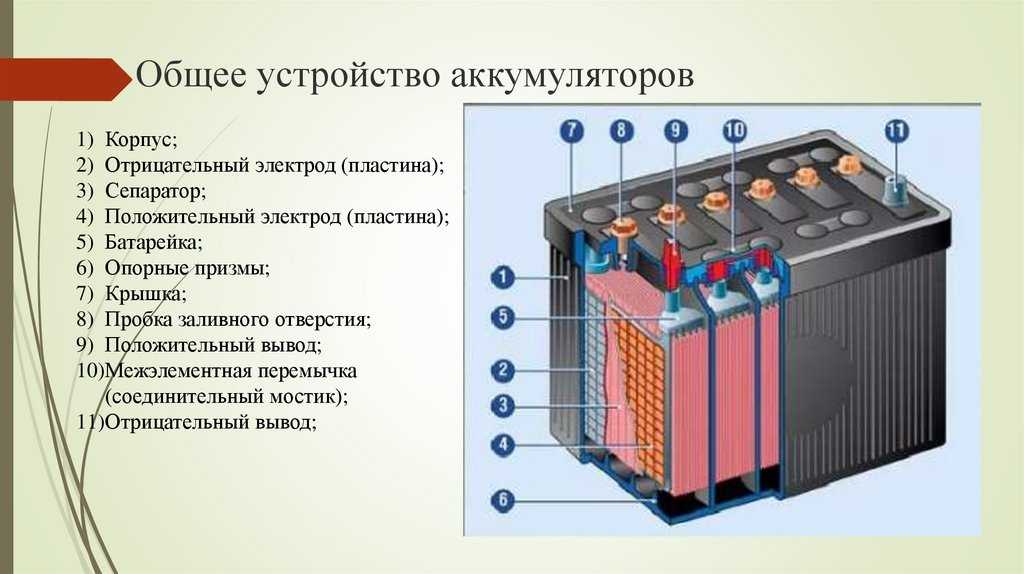 Все те портативные устройства, от которых мы так зависим, были бы такими ограниченными! Мы смогли бы донести наши ноутбуки и телефоны только до предела досягаемости их кабелей, что сделало бы это новое работающее приложение, которое вы только что загрузили на свой телефон, довольно бесполезным.
Все те портативные устройства, от которых мы так зависим, были бы такими ограниченными! Мы смогли бы донести наши ноутбуки и телефоны только до предела досягаемости их кабелей, что сделало бы это новое работающее приложение, которое вы только что загрузили на свой телефон, довольно бесполезным.
К счастью, у нас есть батарейки. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
Изобретение батареи в том виде, в каком мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать точку зрения другого итальянского ученого, Луиджи Гальвани. В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенных на латунных крючках, дергались, если их проткнуть зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.
Вольта, поначалу впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит из двух разных типов металла (крючков, на которых висят лягушки, и другого металла зонда) и просто передается через них, а не через них. из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
Батарея Алессандро Вольта: груда цинковых и серебряных листов с вкраплениями ткани или бумаги, пропитанной соленой водой.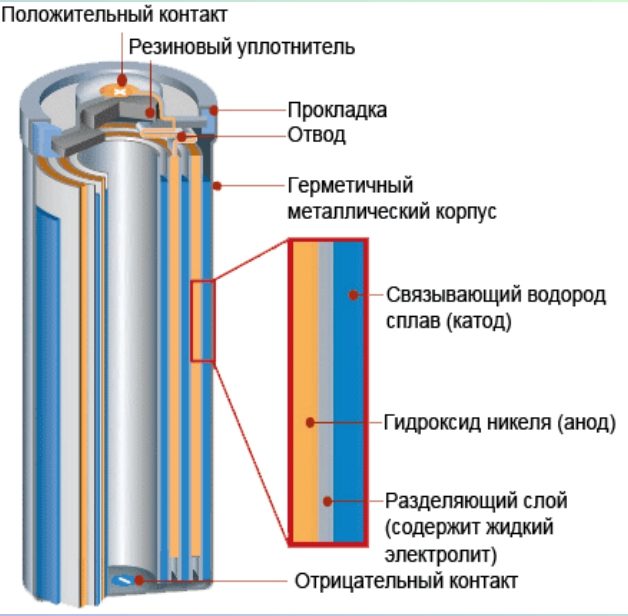 Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.
Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.
Вольта также обнаружил, что, используя различные металлы в куче, можно увеличить величину напряжения. Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. ‘ (мера электрического потенциала) названа в его честь.
Я сам, если не считать шуток, поражаюсь тому, как мои старые и новые открытия… чистого и простого электричества, вызываемого контактом металлов, могли вызвать такой ажиотаж.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра и с дергающимися лягушачьими лапками?
Химия батареи
Батарея представляет собой устройство, которое накапливает химическую энергию и преобразует ее в электричество. Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Так откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Электроды
Чтобы создать поток электронов, вам нужно куда-то, чтобы электроны текли из , и куда-то, чтобы электроны текли к . Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
Как правило, это различные типы металлов или других химических соединений.
В батарее Вольта анодом был цинк, от которого электроны текли по проводу (при подключении) к серебру, которое было катодом батареи. Он сложил множество этих элементов вместе, чтобы сделать общую кучу и поднять напряжение.
Но откуда анод получает все эти электроны? И почему они так счастливы, что их весело отправляют на катод? Все сводится к химии, которая происходит внутри клетки.
Происходит несколько химических реакций, которые нам нужно понять. На аноде электрод вступает в реакцию с электролитом, в результате которой образуются электроны. Эти электроны накапливаются на аноде. Тем временем на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин для обозначения реакции, включающей обмен электронами, представляет собой реакцию восстановления-окисления, чаще называемую окислительно-восстановительной реакцией.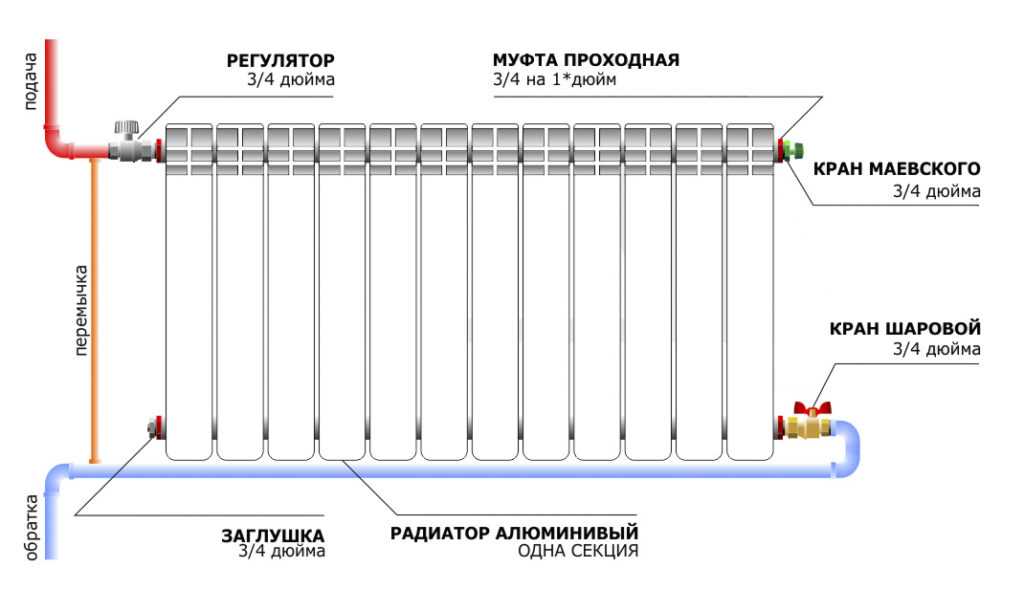 Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности/эффективности реакции либо производить, либо поглощать электроны — ее сила в перетягивании каната электронами.
- Стандартные потенциалы для полуреакций
Ниже приведен список полуреакций, которые включают высвобождение электронов либо из чистого элемента, либо из химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет Е 0 нуля).
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах.Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 подскажут вам, каким образом будет протекать общая реакция: реакция с более отрицательное значение E 0 пожертвует свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном является напряжением ячейки.
Итак, если вы возьмете литий и фтор и сумеете соединить их, чтобы сделать элемент батареи, вы получите максимальное напряжение, теоретически достижимое для гальванического элемента. Этот список также объясняет, почему в куче Вольта цинк был анодом, а серебро катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996).
 .
.Стандартные потенциалы полуреакций восстановления
(по отношению к стандартному водородному электроду при 25°C)
В° (В) Li + (водный) + e − Li(s) –3,040 Be 2+ (водн.) + 2e − Be(s) –1,99 Al 3+ (водн.) + 3e − Al(s) –1,676 Zn 2+ (водный) + 2e − Zn(s) –0,7618 Ag 2 S(s) + 2e − 2Ag(s) + S 2− (водн.) –0,71 Fe 2+ (водн.) + 2e − Fe(s) –0,44 Cr 3+ (водн.) + e − Cr 2+ (водн.) –0,424 Cd 2+ (водн.) + 2e − Cd(s) –0,4030 PbSO 4 (т) + 2e − Pb(т) + SO 4 2− (водн.  )
)–0,356 Ni 2+ (водн.) + 2e − Ni(s) –0,257 2SO 4 2− (водн.) + 4H + (водн.) + 2e − S 2 O 6 − 290940048 (водн.) + 2H 2 O(л) –0,25 Sn 2+ (водн.) + 2e − Sn(s) −0,14 2H + (водн.) + 2e − H 2 (г) 0 Sn 4+ (водн.) + 2e − Sn 2+ (водн.) 0,154 Cu 2+ (водн.) + e − Cu + (водный) 0,159 AgCl(s) + e − Ag(s) + Cl − (водн.) 0,2223 Cu 2+ (водн.) + 2e − Cu(s) 0,3419 O 2 (г) + 2H 2 O(ж) + 4e − 4OH − (водн.  )
)0,401 H 2 SO 3 (водн.) + 4H + (водн.) + 4e − S(т) + 3H 2 O(л) 0,45 I 2 (s) + 2e − 2I − (aq) 0,5355 MnO 4 2− (водн.) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH − 906 0,6 O 2 (г) + 2H + (водн.) + 2e − H 2 O 2 (водный) 0,695 H 2 SeO 3 (водн.) + 4H + + 4e − Se(s) + 3H 2 O(ж) 0,74 Fe 3+ (водн.) + e − Fe 2+ (водн.) 0,771 Ag + (водный) + e − Ag(s) 0,7996 NO 3 − (водн.  ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)0,94 Br 2 (водн.) + 2e − 2Br − (водн.) 1,087 MnO 2 (т) + 4H + (водн.) + 2e − Mn 2+ (водн.) + 2H 2 O(л) 1,23 О 2 (г) + 4H + (водн.) + 4e − 2H 2 O(л) 1,229 CR 2 O 7 2- (AQ) + 14H + (AQ) + 6E — 2CR 3+ (AQ) + 7H 2 2 333333333333333. (AQ) + 7H 2 2 3333333333333333333333. 3+ (AQ) + 7H 2 2 33333333333. 3+ (AQ) + — 2 3+ (AQ) + — 2 3+ (AQ).
1,36 Cl 2 (г) + 2e − 2Cl − (водн.  )
)1,396 Се 4+ (водн.)+е − Се 3+ (водный) 1,44 PBO 2 (S) + HSO 4 — (AQ) + 3H + (AQ) + 2E — PBSO 4 (S) + 2H 2H 3 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2. 1,69 H 2 O 2 (водн.) + 2H + (водн.) + 2e − 2H 2 O(л) 1,763 F 2 (г) + 2е − 2F − (водный) 2,87 Источник: UC Davis ChemWiki
Любые два проводящих материала, вступающих в реакции с разными стандартными потенциалами, могут образовать электрохимическую ячейку, потому что более сильный сможет отбирать электроны у более слабого. Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Разница в стандартном потенциале между электродами примерно равна силе, с которой электроны перемещаются между двумя электродами. Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение батареи, у нас есть два варианта. Мы могли бы выбрать разные материалы для наших электродов, которые придадут клетке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе.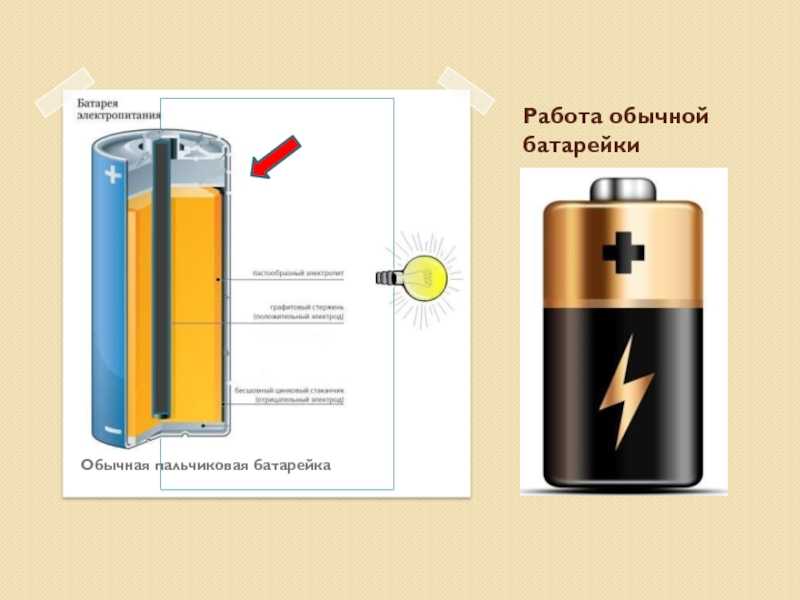 Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда ячейки объединены другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через ячейки, но не как их напряжение.
Электролит
Но электроды — это только часть батареи. Помните бумажки Вольта, смоченные в соленой воде? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электроны имеют отрицательный заряд, и поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ сбалансировать движение этого заряда.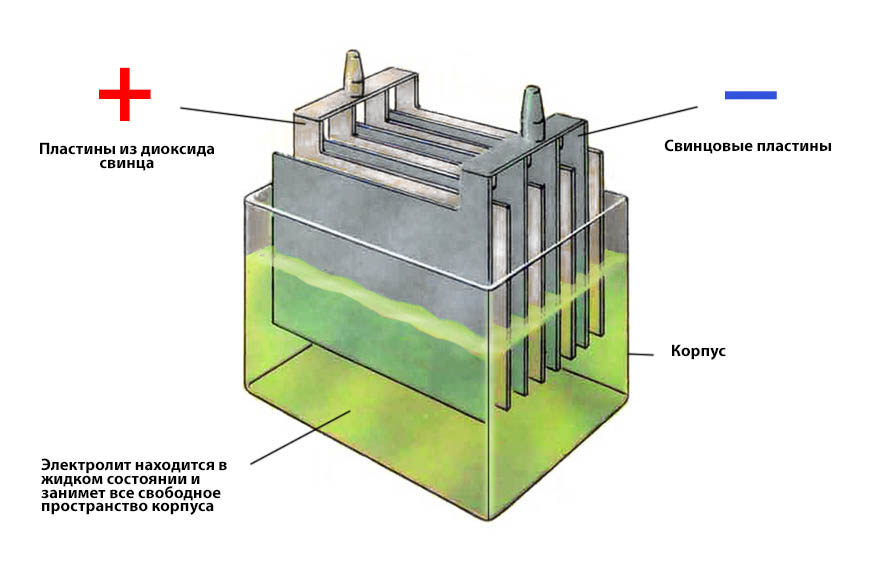 Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Поскольку химическая реакция на аноде приводит к образованию электронов, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
В то же время катод также должен уравновешивать отрицательный заряд электронов, которые он получает, поэтому происходящая здесь реакция должна втягивать положительно заряженные ионы из электролита (в качестве альтернативы она может также высвобождать отрицательно заряженные ионы из электрода в электролит).
Таким образом, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для передачи положительно заряженных ионов, чтобы сбалансировать отрицательный поток. Этот поток положительно заряженных ионов столь же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств. Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Теперь, если позволить всем ионам, выпущенным в электролит, полностью свободно перемещаться через электролит, они закончат тем, что покроют поверхности электродов и засорят всю систему. Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Показывать метки во время анимации
Начать анимацию
При использовании батареи возникает ситуация, при которой происходит непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит). Если этот непрерывный поток остановлен — если цепь разомкнута, например, когда ваш фонарик выключен — поток электронов остановится. Заряды будут накапливаться, и химические реакции, управляющие батареей, прекратятся.
По мере использования батареи и протекания реакций на обоих электродах производятся новые химические продукты. Эти продукты реакции могут создать своего рода сопротивление, которое может помешать протеканию реакции с той же эффективностью.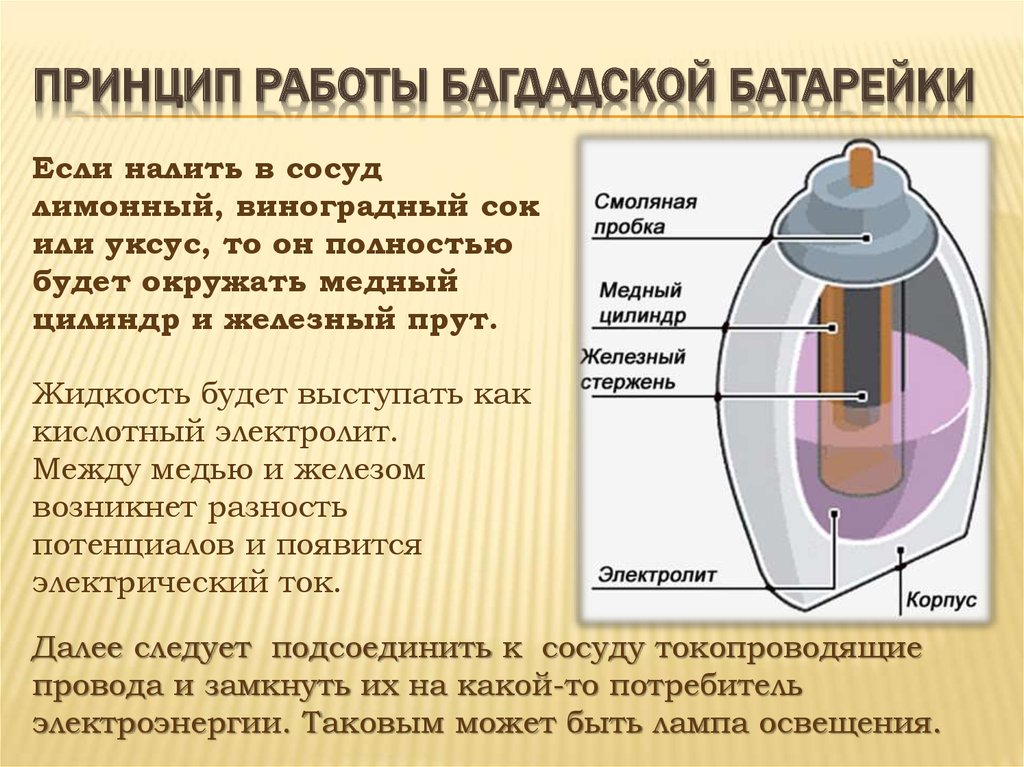 Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Зарядка аккумулятора
Некоторые распространенные батареи предназначены только для одноразового использования (известные как первичные или одноразовые батареи). Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и она закончилась и запылилась. Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Но. Преимущество этого потока ионов и электронов в том, что он имеет место в некоторых типах батарей с соответствующими материалами электродов, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь. . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
. Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
Когда мы подключаем почти разряженную батарею к внешнему источнику электроэнергии и отправляем энергию обратно в батарею, она обращает вспять химическую реакцию, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а электроны, которые принял катод, также возвращаются к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Показывать метки во время анимации
Начать анимацию
Однако процесс не идеален. Замена отрицательных и положительных ионов из электролита обратно на соответствующий электрод по мере перезарядки батареи происходит не так аккуратно и красиво, как электрод изначально. Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
В течение нескольких циклов зарядки и разрядки форма кристаллов батареи становится менее упорядоченной. Это усугубляется, когда батарея разряжается/заряжается с высокой скоростью, например, если вы едете на своем электромобиле с большими рывками, а не постоянно. Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Эффект памяти и саморазряд
Почти полностью обратимые реакции разрядки и перезарядки также способствуют так называемому «эффекту памяти». Когда вы перезаряжаете некоторые типы перезаряжаемых батарей, предварительно не разрядив их в достаточной степени, они «вспоминают», на каком уровне они были в предыдущих циклах разрядки, и не заряжаются должным образом.
В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как соль затем снова растворяется, а металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Способ формирования некоторых кристаллов очень сложен, и способ осаждения некоторых металлов во время перезарядки также удивительно сложен, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие. Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т. д., и наша батарея накапливает некоторые плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.
Еще один аспект перезаряжаемых батарей заключается в том, что химический состав, делающий их перезаряжаемыми, также означает, что они имеют более высокую склонность к саморазряду. Это когда внутри элемента батареи происходят внутренние реакции, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы батареи и заставляет ее умирать при хранении.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда, около 2–3 % в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны — они имеют тенденцию терять 4–6 %. в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.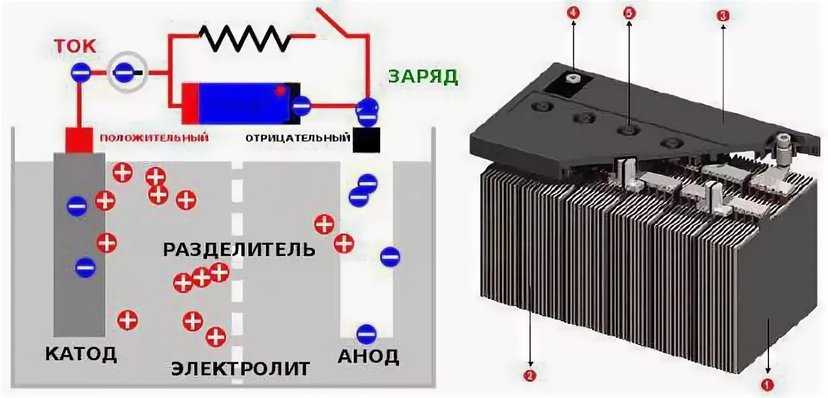
Напряжение, ток, мощность, мощность… в чем разница?
Все эти слова в основном описывают мощность батареи, верно? Ну вроде. Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в движение батарею, проталкивает электроны через ячейку. Это также известно как электрический потенциал и зависит от разности потенциалов между реакциями, происходящими на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем большую работу может совершить одно и то же число электронов.
Ток = количество электронов, проходящих через любую точку цепи в данный момент времени. Чем больше сила тока, тем больше работы он может совершить при том же напряжении. Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем выше скорость, с которой батарея может работать — это соотношение показывает, насколько важны напряжение и ток для определения того, для чего подходит батарея.
Емкость = мощность батареи как функция времени, которая используется для описания периода времени, в течение которого батарея сможет питать устройство. Аккумулятор большой емкости сможет работать в течение более длительного периода, прежде чем разрядится или разрядится. У некоторых аккумуляторов есть небольшая грустная особенность: если вы попытаетесь извлечь из них слишком много слишком быстро, вовлеченные химические реакции не смогут продолжаться, и емкость уменьшится! Таким образом, мы всегда должны быть осторожны, когда говорим о емкости батареи и помнить, для чего она будет использоваться.
Другой популярный термин — «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане.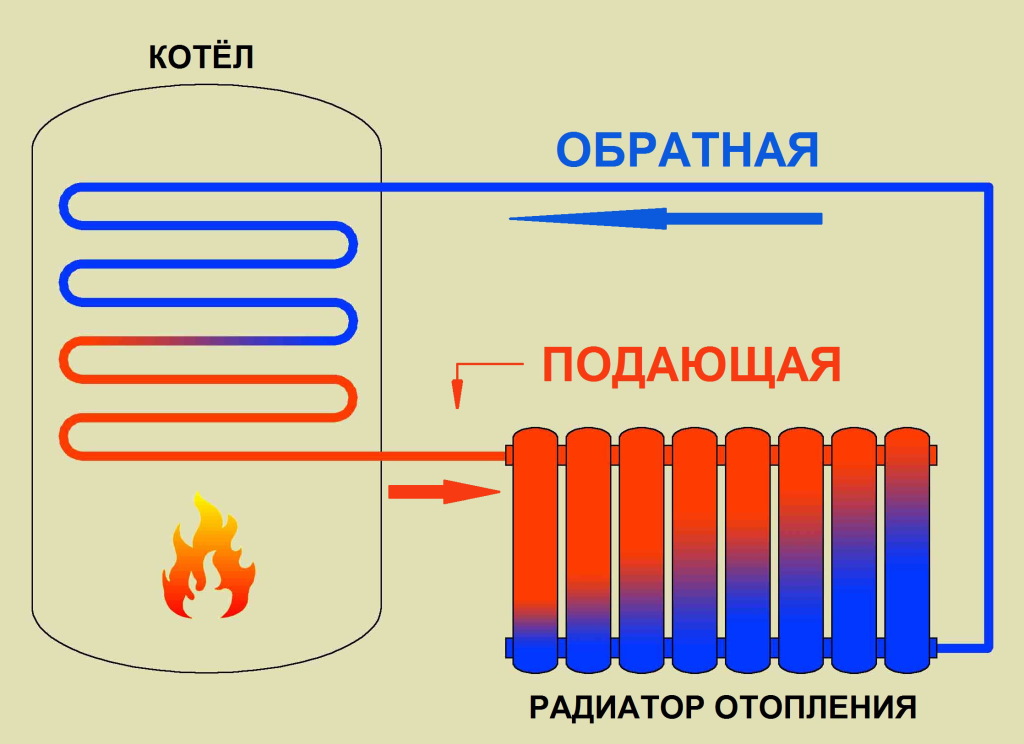 Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для некоторых приложений, таких как хранение электроэнергии на возобновляемой электростанции, такой как ветряная или солнечная электростанция, высокая плотность энергии не является большой проблемой, так как у них, скорее всего, будет достаточно места для хранения батарей. Основной целью такого использования было бы просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Видео: Как работают аккумуляторы? (TED-Ed/YouTube). Посмотреть подробности и расшифровку.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) можно использовать в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию. Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы кладете их вместе в элемент батареи.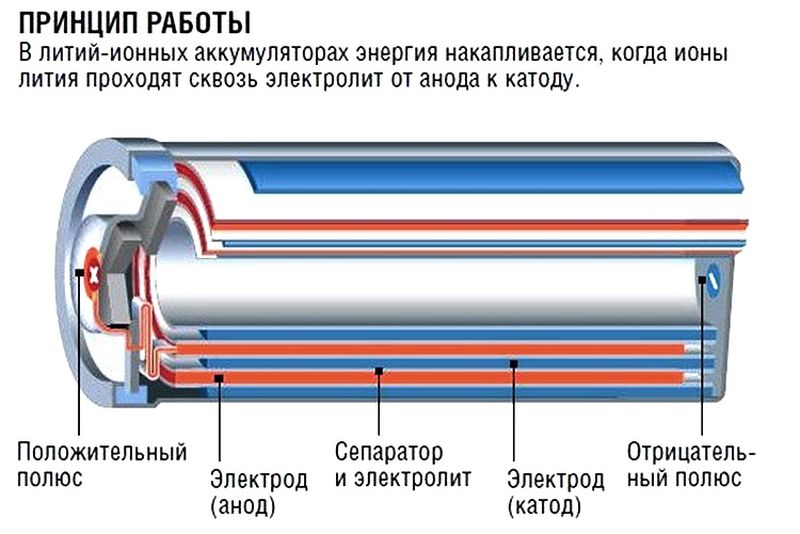 Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Другие комбинации дадут лишь струйку тока, но они будут поддерживать эту струйку на века. Например, нам не нужно большое количество тока для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Еще одна причина для использования различных комбинаций металлов заключается в том, что часто для получения требуемого напряжения необходимо сложить два или более аккумуляторных элемента, и оказывается, что некоторые комбинации электродов складываются гораздо лучше, чем другие комбинации. Например, литий-железо-фосфатные аккумуляторы (разновидность литий-ионных аккумуляторов), используемые в электромобилях, объединяются вместе для создания высоковольтных систем (100 и даже более вольт), но вы никогда не сделаете этого с теми никель-кадмиевыми аккумуляторами Walkman, которые получают горячий!
Наши различные потребности со временем привели к разработке огромного количества типов батарей.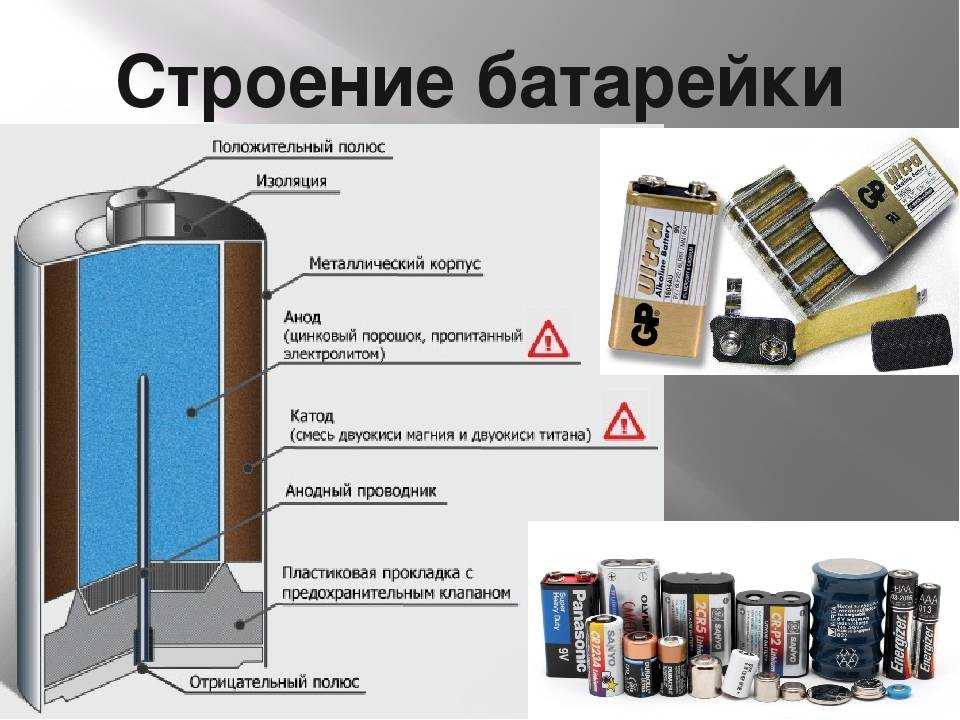 Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Эта тема является частью нашей серии статей о батареях, состоящей из четырех частей. Для дальнейшего чтения см. Типы аккумуляторов, литий-ионные аккумуляторы и аккумуляторы будущего.
Инженерная школа Массачусетского технологического института | » Как работает батарея?
Как работает батарея?
Ваши часы, ноутбук и лазерная указка питаются от одного и того же: химии…
Автор: Мэри Бейтс
Существует множество различных типов батарей, но все они работают по одному и тому же принципу. «Аккумулятор — это устройство, способное накапливать электрическую энергию в виде химической энергии и преобразовывать эту энергию в электричество», — говорит Антуан Алланоре, научный сотрудник факультета материаловедения и инженерии Массачусетского технологического института. «Вы не можете поймать и сохранить электричество, но вы можете хранить электрическую энергию в химических веществах внутри батареи».
Аккумулятор состоит из трех основных компонентов: двух выводов, изготовленных из различных химических веществ (обычно металлов), анода и катода; и электролит, который разделяет эти клеммы. Электролит представляет собой химическую среду, которая обеспечивает протекание электрического заряда между катодом и анодом. Когда устройство подключено к батарее — лампочке или электрической цепи — на электродах происходят химические реакции, которые создают поток электрической энергии к устройству.
Более конкретно: во время разряда электричества химическое вещество на аноде высвобождает электроны на отрицательную клемму и ионы в электролит посредством так называемой реакции окисления. Между тем, на положительной клемме катод принимает электроны, замыкая цепь потока электронов. Электролит предназначен для того, чтобы привести различные химические вещества анода и катода в контакт друг с другом таким образом, чтобы химический потенциал мог уравновешиваться от одного вывода к другому, преобразовывая накопленную химическую энергию в полезную электрическую энергию.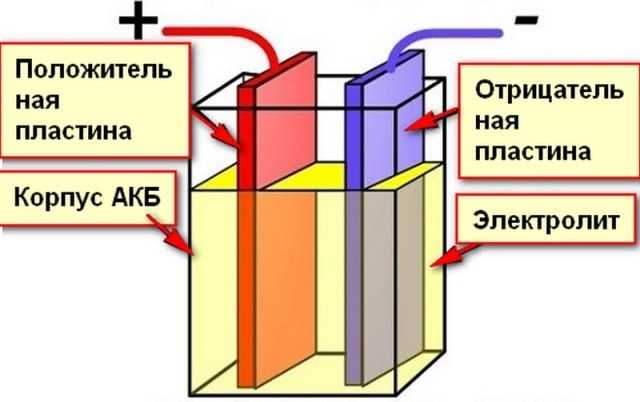 «Эти две реакции происходят одновременно», — говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и именно это генерирует электрический ток».
«Эти две реакции происходят одновременно», — говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и именно это генерирует электрический ток».
Если батарея одноразовая, она будет производить электричество до тех пор, пока не закончатся реагенты (одинаковый химический потенциал на обоих электродах). Эти батареи работают только в одном направлении, преобразуя химическую энергию в электрическую. Но в других типах аккумуляторов реакция может быть обратной. Перезаряжаемые батареи (например, в вашем мобильном телефоне или в вашем автомобиле) сконструированы таким образом, что электрическая энергия из внешнего источника (зарядное устройство, которое вы подключаете к стене, или динамо-машина в вашем автомобиле) может быть применена к химической системе и наоборот. его работы, восстанавливая заряд аккумулятора.
Лаборатория Group Sadoway в Массачусетском технологическом институте работает над созданием более эффективных аккумуляторов для многократного использования.
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах. .
. )
) )
) ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)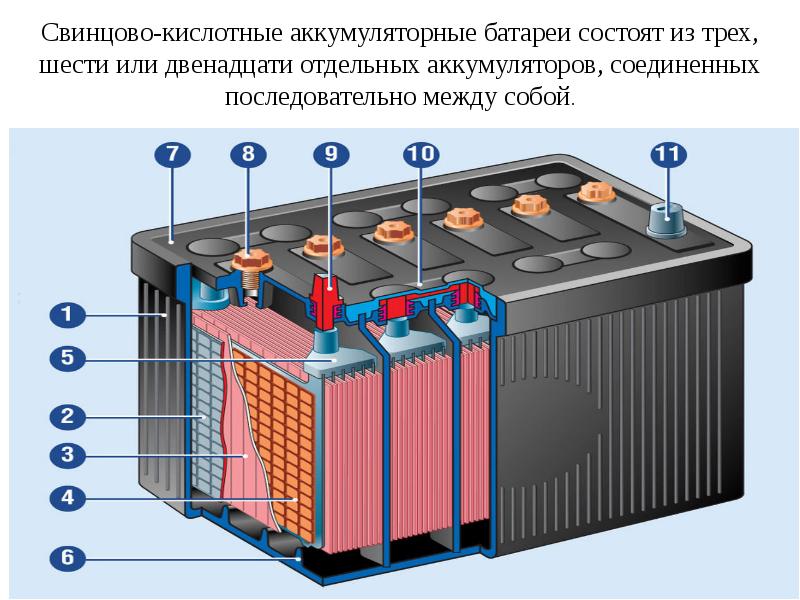 )
)