Содержание
Какая технология сможет сместить литийионные аккумуляторы с лидирующей позиции? И когда? — НПП Итэлма на vc.ru
131
просмотров
В конце 2020 года выпустили огромную литийионную батарею. Её ёмкости хватит, чтобы обеспечить энергией 225 тысяч домов в течение четырёх часов. И работает она по тому же принципу, что и аккумулятор в Вашем смартфоне.
Всё гениальное просто
Литийионные аккумуляторы встречаются повсеместно: ими оснащены смартфоны, планшеты, электромобили, ноутбуки и огромное количество бытовой техники.
Принцип работы литиевого аккумулятора.
Принцип работы максимально прост. Аккумулятор состоит из отрицательного и положительного электрода. Анод и катод. Минус и плюс. Чаще всего плюс изготавливают из оксида кобальта, а минус из графита. Встречается множество вариантов.
На минусе в графите находятся литиевые атомы, содержащие отрицательные частицы, которые плюс хочет забрать к себе из-за их недостатка. Однако специальный сепаратор или же жидкий электролит препятствуют этому процессу, т.к. передают лишь положительный заряд.
Однако специальный сепаратор или же жидкий электролит препятствуют этому процессу, т.к. передают лишь положительный заряд.
Плюс и минус подключают к соответствующим выходам устройства, и литиевые атомы устремляются по длинному маршруту через весь ноутбук/смартфон/электромобиль на плюс. Когда литий теряет электрон, он превращается в положительный ион и попадает на плюс без препятствий.
Этот процесс будет происходить до тех пор, пока подключен потребитель, и пока на минусе не остаётся электронов лития. Тогда аккумулятор разряжается. После подключения блока питания запускается химическая реакция, и электроны лития возвращаются на минус. Аккумулятор заряжен, процесс можно начинать заново.
Первый коммерческий литийионный аккумулятор появился 30 лет назад в любительской видеокамере от Sony. Литийионный аккумулятор незначительно дорабатывался, но общий принцип остался неизменным.
Батарейки ААА и огромное хранилище энергии работают одинаково
В одной из статей мы упоминали о строительстве аккумуляторной сети мощностью 1.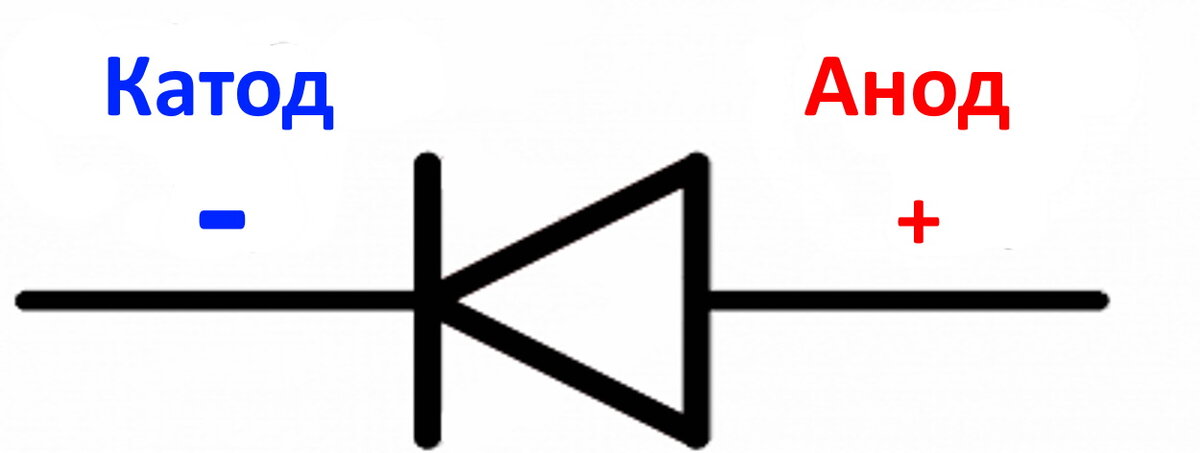 2 гигаватта в Австралии. Запланированная сеть, равно как и самая большая батарейка в мире на берегу Калифорнии, в сущности является просто литийионным аккумулятором, только большего масштаба.
2 гигаватта в Австралии. Запланированная сеть, равно как и самая большая батарейка в мире на берегу Калифорнии, в сущности является просто литийионным аккумулятором, только большего масштаба.
Специальные аккумуляторные шкафы/стойки служат для масштабирования аккумуляторов.
Постройкой больших аккумуляторов решают проблему с излишками электроэнергии. К примеру, в солнечную погоду солнечные панели накапливают максимальное количество электроэнергии, но эти часы не совпадают с часами максимальной нагрузки на сети электроэнергии (как правило это вечерние и утренние часы). Именно там и хранятся излишки чистой, экологичной энергии, которые могут пригодиться в дальнейшем.
Недостатки Li-Ion аккумуляторов
Само собой, такой тип батарей не является идеальным. И пусть он выгодно отличается от остальных стоимостью, небольшими габаритами и ёмкостью, но вопрос безопасности все ещё остаётся открытым. Наилучшим примером является нашумевший смартфон Samsung Galaxy Note 7, где из-за недостаточной жесткости конструкции мог возникнуть изгиб в верхнем правом углу аккумулятора. Это обеспечивало контакт плюса с минусом, и, как следствие — происходило короткое замыкание.
Это обеспечивало контакт плюса с минусом, и, как следствие — происходило короткое замыкание.
Samsung Galaxy Note 7 после возгорания.
К счастью, Galaxy Note 7 является скорее исключением из правил, и если не подвергать аккумуляторы экстремальным условиям (сильные удары, температура горения), они будут стабильно работать. Да, они страдают от саморазряда, со временем теряют ёмкость, зависимы от температур, но для потребителя литийионные аккумуляторы идеальны по соотношению цены и характеристик.
Ждать ли революции в мире аккумуляторов?
На протяжении пары десятков лет периодически появляются новости о революции в мире аккумуляторов. Например, мы с нетерпением ждём тех же графено-алюминиевых аккумуляторов. К сожалению, с новыми наработками всегда что-то бывает не так. Например, большое количество циклов повторного заряда осуществимо лишь для миниатюрных батарей, или же батарея сильно потеряет в ёмкости уже через 10 циклов.
Бывают и вовсе необычные решения. Чего только стоит аккумулятор на основе топливной ячейки, работающей на метаноле. Такую батарею 17 лет назад Toshiba установила в свой МР3 плеер.
Для зарядки нужно было долить метанола в аккумулятор. Одного кубического сантиметра хватало приблизительно на 10 часов работы. Но идея постоянно носить с собой запас метанола для мр3 плеера не заинтересовала широкую публику.
Есть ли аналоги литийионным аккумуляторам? Заменить их на сегодняшний день просто некому. Да, есть литийметаллические батареи от Solid Energy, над которым они начали работу ещё в 2012 году. И графено-алюминиевые батареи. Но все они пока еще в разработке. Остаётся лишь надеяться на очередную революцию в мире аккумуляторов, ведь последняя была 30 лет назад.
Мы большая компания-разработчик automotive компонентов. В нашем штате около 2500 сотрудников, в том числе 650 инженеров.
Мы, пожалуй, самый сильный в России центр компетенций по разработке автомобильной электроники.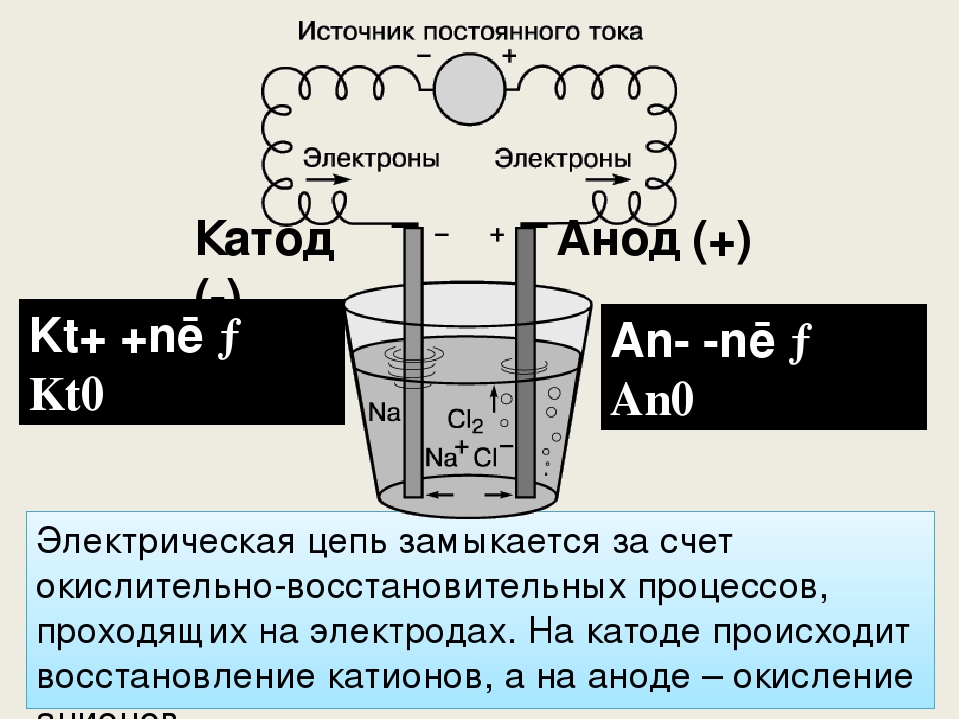 Мы активно растем, и открыли много вакансий, в том числе и в регионах. Нам нужны инженеры-программисты, инженеры-конструкторы, ведущие инженеры-разработчики (DSP-программисты) и др.
Мы активно растем, и открыли много вакансий, в том числе и в регионах. Нам нужны инженеры-программисты, инженеры-конструкторы, ведущие инженеры-разработчики (DSP-программисты) и др.
У нас много интересных задач от автопроизводителей и концернов, двигающих индустрию. Если хотите расти в этой области и учиться у лучших — рады видеть вас в команде. Также мы готовы делиться экспертизой и важными новостями из мира automotive. Задавайте нам любые вопросы: ответим, обсудим.
Читать ещё полезные статьи:
Российские учёные улучшат характеристики литий-ионных батарей
СМИ о нас
3DNews
Учёные из Института физики им. Л. В. Киренского ФИЦ КНЦ СО РАН совместно с коллегами из СФУ и Национального исследовательского технологического университета «МИСиС» предложили новую технологию, позволяющую существенно улучшить ключевые характеристики литий-ионных аккумуляторов.
О новом достижении сообщает Федеральное агентство научных организаций (ФАНО).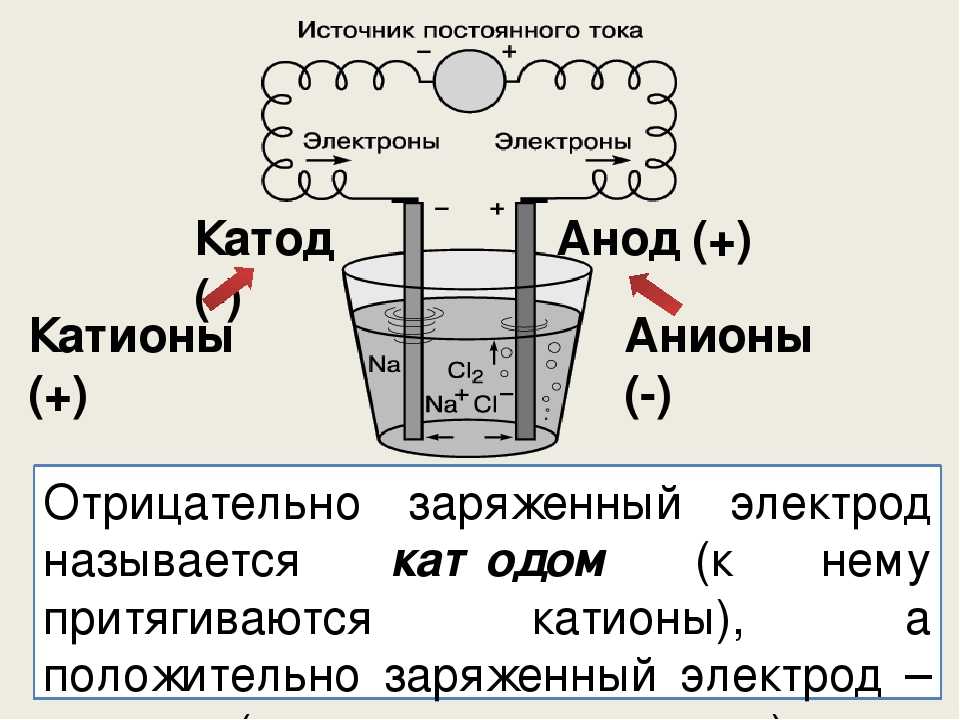 Усилия российских специалистов были направлены на повышение ёмкости и максимальной скорости заряда-разряда литий-ионных батарей. Для этого предложено использовать особое соединение графена.
Усилия российских специалистов были направлены на повышение ёмкости и максимальной скорости заряда-разряда литий-ионных батарей. Для этого предложено использовать особое соединение графена.
Физическая основа литий-ионного аккумулятора — два электрода, анод (плюс) и катод (минус), разделённые пористым полимерным материалом. Во время зарядки электрический ток перемещает ионы лития от катода к аноду, а во время работы батареи ионы движутся обратно. Когда срок службы батареи подходит к концу, возможность для перемещения ионов лития между электродами снижается.
Учёные предложили использовать в качестве анодного материала для литий-ионных батарей двуслойную гетероструктуру, состоящую из монослоев дисульфида ванадия и графена. Ионы лития могу связываться не только на поверхности такого материала, но и в межслоевом пространстве, что в конечном итоге приводит к его высокой удельной ёмкости.
В частности, расчёты показали, что возможная ёмкость такого композита составит 569 мА·ч на один грамм анодного материала.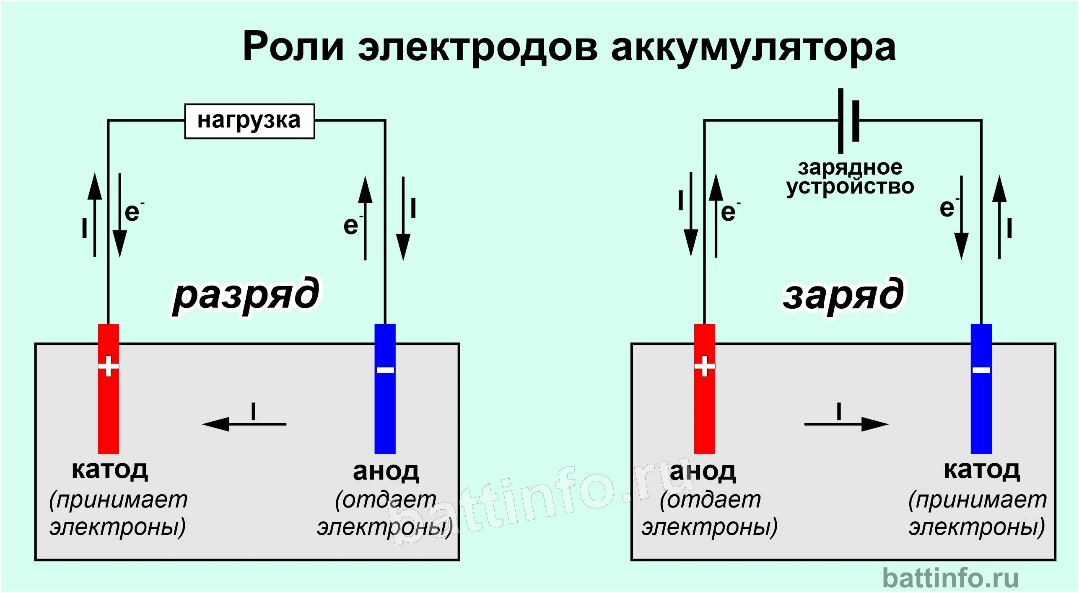 Это почти в два раза выше, чем у графита — наиболее часто используемого анода в современных литий-ионных батареях.
Это почти в два раза выше, чем у графита — наиболее часто используемого анода в современных литий-ионных батареях.
Кроме того, зафиксирована высокая подвижность ионов лития. Это теоретически обеспечит более высокую скорость зарядки и возможность питания устройств повышенной мощности.
Поделиться
- В России разработали новый сплав для авиации и космонавтики
- Samsung нашел способ впятеро ускорить зарядку аккумуляторов
- Российские учёные улучшат характеристики литий-ионных батарей
- Цитируемость университета выросла втрое
- Взрывное дело: как гибель брата подтолкнула Нобеля к идее создания динамита
НовостиСМИ о нас
Свежие
СМИ о нас
Поступающим
5-100
Объявления приемной комиссии
Наука
Образование
Международное сотрудничество
Университетская жизнь
Достижения науки
Научное сообщество
Федеральные целевые программы
Взаимодействие с бизнесом
COVID-19
Объявления для студентов
Объявления Центра подготовки кадров высшей квалификации
НИТУ МИСИС меняет мир
Достижения студентов
Поздравления
Импортозамещение
Мероприятия и выставки
ЦИНТИ
Программа «Приоритет 2030»
21 октября
В России нашли способ очистить сточные воды от антибиотиков
21 октября
В НИТУ МИСИС придумали, как быстро и эффективно очистить сточные воды от антибиотиков
14 октября
ОМК поддержала новый образовательно-производственный кластер в Выксе
Читать все новости
17.
 2: Электролиз — Химия LibreTexts
2: Электролиз — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 49549
- Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф и Адам Хан
- Цифровая библиотека химического образования (ChemEd DL)
Типичный электролизер можно изготовить, как показано на рисунке \(\PageIndex{1}\). Два электрических проводника ( электроды ) погружаются в электролизуемую жидкость. Эти электроды часто изготавливаются из инертного материала, такого как нержавеющая сталь, платина или графит. Электролизуемая жидкость должна быть способна проводить электричество, поэтому обычно это водный раствор электролита или расплавленное ионное соединение. Электроды подключаются проводами к батарее или другому источнику постоянного тока. Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, а электрод, к которому они поступают, имеет избыток электронов и отрицательный заряд.
Электроды подключаются проводами к батарее или другому источнику постоянного тока. Этот источник тока можно рассматривать как «электронный насос», который забирает электроны с одного электрода и выталкивает их на другой электрод. Электрод, с которого удаляются электроны, становится положительно заряженным, а электрод, к которому они поступают, имеет избыток электронов и отрицательный заряд.
Рисунок \(\PageIndex{1}\): электролизер. Батарея перекачивает электроны от анода (делая его положительным) к катоду (делая его отрицательным). Положительный анод притягивает к себе анионы, а отрицательный катод притягивает к себе катионы. Электрический ток переносится электронами в проводе и электродах, но он переносится анионами и катионами, движущимися в противоположных направлениях в самой клетке. Поскольку анод может принимать электроны, на этом электроде происходит окисление. Катод является донором электронов и может вызывать восстановление.
Отрицательно заряженный электрод будет притягивать к себе положительные ионы (катионы) из раствора. Он может отдавать часть своих избыточных электронов таким катионам или другим веществам в электролизуемой жидкости. Следовательно, этот электрод фактически является восстановителем. В любом электрохимическом элементе (электролитическом или гальваническом) электрод, на котором происходит восстановление , называется катодом .
Он может отдавать часть своих избыточных электронов таким катионам или другим веществам в электролизуемой жидкости. Следовательно, этот электрод фактически является восстановителем. В любом электрохимическом элементе (электролитическом или гальваническом) электрод, на котором происходит восстановление , называется катодом .
Положительный электрод, с другой стороны, будет притягивать к себе отрицательные ионы (анионы). Этот электрод может принимать электроны от этих отрицательных ионов или других частиц в растворе и, следовательно, ведет себя как окислитель. В любой электрохимической ячейке анод — это электрод, на котором происходит окисление . Простой способ запомнить, какой электрод есть какой, состоит в том, что анод и окисление начинаются с гласных, а катод и восстановление начинаются с согласных.
На следующем видео показан этот процесс, происходящий в нейтральном водном растворе с некоторыми электролитами.
В качестве примера того, как электролиз может вызвать химическую реакцию, предположим, что мы пропускаем постоянный электрический ток через 1 M 9{-}(водн. ) \rightarrow \text{H}_2(g) + \text{Cl}_2(g) + \text{2H}_2\text{O}(l) \nonumber \]
) \rightarrow \text{H}_2(g) + \text{Cl}_2(g) + \text{2H}_2\text{O}(l) \nonumber \]
Суммарная реакция в уравнении \ref{3} представляет собой обратную спонтанную комбинацию \(\ce{h3(g)}\) с C\(\ce{Cl2(g)}\) с образованием \ (\ce{HCl(водн.)}\). Такой результат верен для электролиза вообще: электрический ток, подаваемый извне, вызывает несамопроизвольную химическую реакцию.
Хотя электролиз всегда обращает спонтанную окислительно-восстановительную реакцию, результат данного электролиза не всегда может быть той реакцией, которую мы хотим. Например, в водном растворе вблизи анода и катода всегда находится очень много молекул воды. Эти молекулы воды могут отдавать электроны аноду или принимать электроны от катода точно так же, как анионы или катионы. Следовательно, электролиз может окислять и/или восстанавливать воду вместо того, чтобы вызывать реакцию растворенного электролита. Примером этой проблемы является электролиз фторида лития \(\ce{LiF}\). Можно ожидать восстановления \(\ce{Li^{+}}\) на катоде и окисления \(\ce{F^{–}}\) на аноде в соответствии с полууравнениями 9{-}\метка{8} \]
Общее уравнение можно получить, умножив уравнение \(\ref{7 }\ ) на 2, добавив его к уравнению \(\ref{8}\) и объединив H + с OH – , чтобы получить Н 2 О:
\[\text{2H}_2\text{O}(l) \rightarrow \text{2H}_2(g) + \text{O}_2(g) \nonumber \]
В следующем видео показан электролиз воды с использованием серной кислоты в качестве мостика для переноса заряда. После завершения электролиза идентичность образовавшихся газов проверяют с помощью испытаний на сжигание щепы.
После завершения электролиза идентичность образовавшихся газов проверяют с помощью испытаний на сжигание щепы.
Таким образом, этот электролиз обращает спонтанную комбинацию H 2 и O 2 с образованием H 2 O. При обсуждении окислительно-восстановительных реакций мы упоминаем несколько окислителей, таких как достаточно сильные, чтобы окислить H 2 O. В то же время мы описываем восстановители, достаточно сильные для восстановления H 2 O, такие как щелочные металлы и более тяжелые щелочноземельные металлы. Как правило, такие вещества не могут быть получены электролизом водных растворов, поскольку H 9{–}}\).
Следовательно, мы ожидаем, что O 2 , а не Cl 2 , будет получен электролизом 1 M HCl, что противоречит уравнению \(\ref{1}\). Получается, что O 2 образуется более медленнее , чем Cl 2 , и последний пузырится из раствора раньше, чем H 2 O успевает окислиться. По этой причине таблицу 1 в разделе «Окислительно-восстановительные пары» не всегда можно использовать для предсказания того, что произойдет при электролизе.
По этой причине таблицу 1 в разделе «Окислительно-восстановительные пары» не всегда можно использовать для предсказания того, что произойдет при электролизе.
Эта страница под названием 17.2: Электролиз распространяется под лицензией CC BY-NC-SA 4.0, авторами, ремиксами и/или кураторами являются Эд Витц, Джон В. Мур, Джастин Шорб, Ксавьер Прат-Ресина, Тим Вендорф, и Адам Хан.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ХимПРАЙМ
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- анод
- катод
- электрод
- Электролиз
Видео с вопросами: выбор правильных реакций анодного и катодного равновесия для гальванического элемента с использованием обозначения ячейки
Расшифровка видео
Диаграмма ячейки может
понять реакции на катоде и аноде гальванического элемента: Cu твердая, Cu2+
водный, Ag+ водный, Ag твердый. В какой таблице указаны правильные
реакции катодного и анодного равновесия для этой системы гальванических элементов? (A) Анодная реакция представляет собой твердую медь
реагируя с образованием водного Cu2+ плюс два электрона и катода Ag+ водного плюс
электрон реагирует с образованием твердого Ag.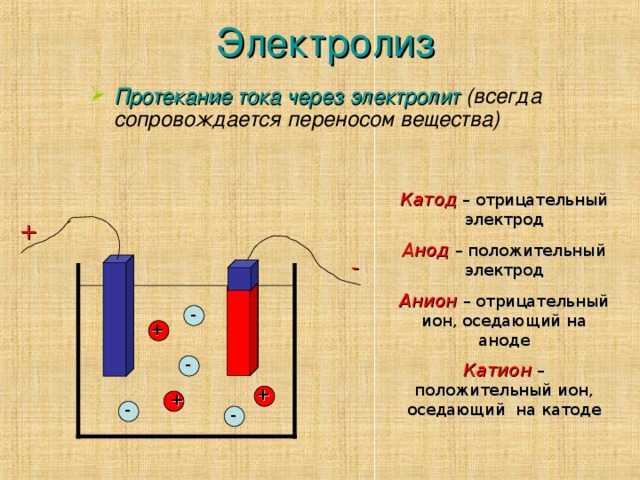 Реакция (B) анод, Ag+ водный
Реакция (B) анод, Ag+ водный
плюс электрон, реагирующий с образованием твердого Ag, и катод, твердый Cu, реагирующий с образованием Cu2+
водный плюс два электрона. Реакция (C) анод, твердая медь
реагируя с образованием водного раствора Cu+ плюс электрон и катода, водного раствора Ag+ плюс электрон
реагирует с образованием твердого Ag. Реакция (D) анод, твердая медь
реагируя с образованием водного раствора Cu2+ плюс два электрона и катода, водного раствора Ag2+ плюс два
электроны, реагирующие с образованием твердого Ag. Или реакционный (E) анод, Ag+ водный
плюс электрон, реагирующий с образованием твердого Ag, и катод, твердый Cu, реагирующий с образованием Cu+
водный плюс электрон.
В этом вопросе мы хотим знать
какие из ответов, которые все показывают разные полууравнения, показывают реакции, которые
соответствуют предоставленным обозначениям ячеек. Для конкретного гальванического элемента
Для конкретного гальванического элемента
это обозначение ячейки, также называемое диаграммой ячейки. Для того, чтобы передать настройку
гальванический элемент, диаграмма ячейки, такая как эта, используется, чтобы показать, какие вещества или
материалы используются для изготовления катода и анода, а также электролитов
в двух полуэлементах гальванического элемента.
Освободим место для осмотра
обозначение ячейки, чтобы увидеть, какая часть является информацией об аноде, а какая —
катодная информация. И исходя из этого мы определим
полуреакции на аноде и катоде.
Гальванический элемент представляет собой
электрохимическая ячейка, в которой электроны спонтанно генерируются окислительно-восстановительным
реакции, а затем проходят через внешнюю цепь. Если мы исследуем гальванический элемент, мы
обнаружите, что он состоит из двух полуэлементов: один является анодом, а другой —
катод. Анод положительный и находится там, где
Анод положительный и находится там, где
происходит окисление, а катод отрицательный и именно там происходит восстановление. Мы можем написать информацию о
полуклетки в обозначении ячеек.
Когда мы записываем эту информацию в
на клеточной диаграмме существуют определенные соглашения, которым мы должны следовать. С левой стороны информация
по поводу анода написано. Начнем с написания металла
символ электрода, в данном случае медный, за которым следует вертикальная линия. Фазовая граница представлена
эта вертикальная линия. Символ и заряд
соответствующий ион в растворе затем записывается для полуэлемента анода. Итак, в этом вопросе мы имеем
раствор, содержащий два плюс иона меди. Иногда концентрация
решение написано в скобках, хотя и не в этом примере.
Соляной мост, соединяющий два
полуклетки изображаются двойной вертикальной чертой. С правой стороны информация
С правой стороны информация
относительно катода написано, в том числе ион металла в растворе, который в этом
случай Ag+ или ионы серебра один. Существует вертикальная линия для
фазовая граница и символ катодного металла, которым в данном случае является серебро,
символ Аг.
Так как мы знаем левую часть
обозначение ячейки показывает анод, и в этом случае медь окисляется до меди
два плюс, мы можем сделать вывод, что половина реакции окисления — это реакция твердого вещества Cu
обратимо с образованием водного Cu2+ плюс два электрона. А с правой стороны от
обозначение ячейки на катоде, мы знаем, что восстановление происходит с ионами серебра плюс
превращается в металл серебра, при этом полуреакцией восстановления является Ag+
водный плюс электрон обратимо реагируют с образованием твердого Ag.
Вопрос задал нам определить
правильные катодные и анодные равновесные реакции для этого гальванического элемента
система.
