Содержание
что это такое, где плюс и где минус на диоде
Классические термины из физики и химии часто встречаются в инструкциях к использованию современных приборов. Необходимо точно знать, что такое определение под собой подразумевает и как его применять к тем или иным конструкциям и явлениям.
Содержание
- Что такое анод и катод
- Анод
- Катод
- Как определить анод и катод
- Сфера применения
- Электрохимия
- Гальванотехника
- Вакуумные и полупроводниковые электроприборы
Что такое анод и катод
Потребитель сталкивается с понятиями анод и катод при зарядке и разрядке аккумулятора, зарядке и обслуживании батареи.
Понять разницу между катодом, анодом, положительным и отрицательным зарядом проще всего, вспомнив некоторые положения из электрохимии.
- Гальванические элементы – электрический ток производится благодаря текущей химической реакции. Именно на этом принципе работают батарейки и аккумуляторы.
 Поэтому их называют химическими источниками тока.
Поэтому их называют химическими источниками тока. - Электролиз – химическая реакция, которая протекает за счет включения в систему источника электроэнергии.
В обоих случаях один из электродов несет более высокий потенциал. Этот электрод считается положительным. Электрод с более низким потенциалом и необязательно отрицательным, будет носить название отрицательный. Ток, соответственно, течет от носителя более высокого потенциала к носителю более низкого потенциала.
Да, часто
54.55%
Очень редко
29.55%
Не припоминаю
15.91%
Проголосовало: 44
Анод
По определению анодом выступает электрод, на котором протекает окислительная реакция. Это означает, что электрод служит источником электронов. В химии его же нередко именуют восстановителем.
Катод
Под катодом подразумевают электрод, на котором протекает реакция восстановления. Здесь электрод забирает электроны и называется окислителем.
Принимая, что ток является движением положительно заряженных частиц, а не отрицательных, получается, что ток в растворе идет от катода к аноду. В цепи, соединяющей элементы гальванической пары, электроны идут от минуса к плюсу и с этой точки зрения катод является плюсом, а анод – минусом.
Противоречие кажущееся, ведь направление тока определяется движением положительных частиц, хотя фактически в металлической цепи его обеспечивает движение электронов.
Как определить анод и катод
Если с батарейкой все довольно просто (полюс и минус не меняются местами), то с зарядкой аккумулятора дело обстоит сложнее.
Во время зарядки разность между большим и меньшим потенциалом увеличивается, то есть потенциал положительного электрода становится выше, чем его же потенциал в покое – накапливается заряд, а потенциал отрицательного электрода становится меньше, чем он же в состоянии покоя. Отсюда вытекает, что положительный электрод выступает анодом, а отрицательный – катодом.
При использовании устройства потенциал положительного электрода (анода) всегда остается больше, чем потенциал отрицательного (катода). Но во время цикла разрядки/зарядки роль электрода меняется: при разрядке положительным становится катод, отрицательным – анод. Во время зарядки положительным выступает анод, отрицательным – катод.
Если речь идет о растворах и электрофизических реакциях в них, проще запомнить, что катионы – всегда частицы с положительным зарядом, а значит двигаются к минусу. Анионы – частицы всегда с отрицательным зарядом и двигаются к плюсу.
Валера
Голос строительного гуру
Задать вопрос
Чтобы запомнить, где плюс, где минус, используют мнемоническое правило. В словах «катод» и «минус», а также в словах «анод» и «плюс» одинаковое количество букв. В нормальном режиме работы любого электрического прибора ток вытекает из катода и втекает в анод. Даже если речь о металлической жиле, поскольку здесь направление тока определяют не смещении электронов, а смещение дырок.
Сфера применения
В промышленности используют не только собственно гальванические элементы (для получения электрического тока), но и электрохимические реакции, которые протекают под действием тока. Самый известный – получение тонкопослойного защитного покрытия стали – из цинка, алюминия, цинкового-алюминиевых сплавов.
Электрохимия
Электролиз по своему значению противоположен работе гальванического элемента: реакция проходит под действием тока. При этом плюс источника питания все же именуется катодом, а минус анодом, что как бы противоречит вышесказанному. Происходит это потому, что ток от плюсового вывода источника питания уходит на плюсовой вывод аккумулятора и в этом случае последний уже никак не может быть катодом. В результате электроды аккумулятора при зарядке меняются местами, потому что реакция идет в обратном направлении.
Гальванотехника
Посеребрение, золочение, хромирование, оцинковка – наиболее известные способы использования процесса осаждения вещества. Принцип действия таких установок одинаков: изделие погружают в электролитическую ванную, в которой оно выступает катодом. На его поверхности осаждаются ионы металла – катионы. Чтобы изделие стало катодом, к нему подключают плюсовой вывод источника питания.
Принцип действия таких установок одинаков: изделие погружают в электролитическую ванную, в которой оно выступает катодом. На его поверхности осаждаются ионы металла – катионы. Чтобы изделие стало катодом, к нему подключают плюсовой вывод источника питания.
Вакуумные и полупроводниковые электроприборы
Понятие катода и анода, а точнее плюса и минуса в вакуумных и полупроводниковых приборах связано с возможностью протекания тока только в одном направлении или в двух. Полупроводник допускает только прямое течение тока, а при наложении напряжения обратного типа ток здесь течет, но крайне незначительно. Для резистора же вопрос не принципиален: он пропускает ток в обоих направлениях.
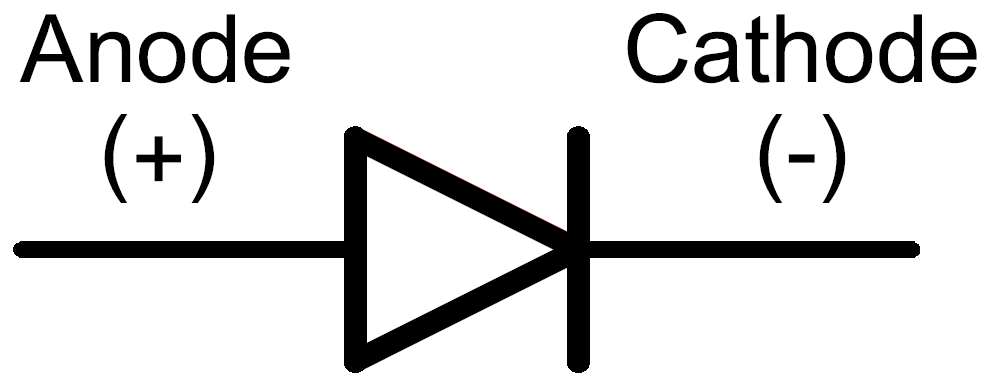
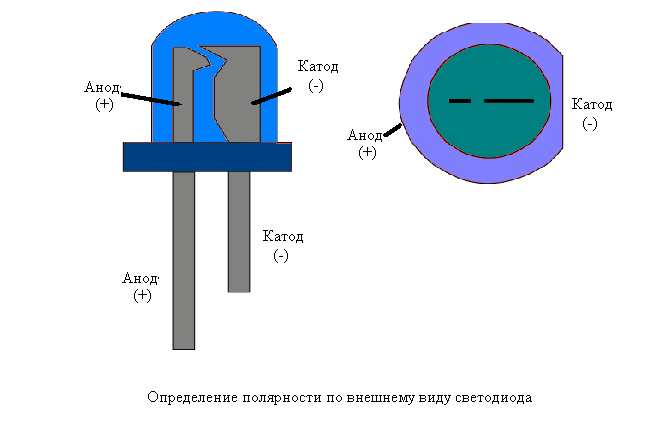
Катодом и анодом называют выводы диода – ножки. К плюсу батареи подключается анод. Называется он так, потому что у диода в ток любом случае втекает в анод. Светодиод и даже вакуумный подключается точно так же: анод к плюсу, а катод к минусу.
У пассивных потребителей катод и анод (плюс и минус) не меняются. У активных, способных пропускать ток в обоих направлениях, разряжаться и заряжаться – плюсы и минус могут меняться. В аккумуляторе катод положительный во время разрядки и отрицательный при зарядке. Для правильного использования приборов и элементов важно помнить одно: у всех потребителей энергии – электронных деталей, электролизеров, гальванических батарей − вывод, подключаемый к плюсу, называется анодом.
У активных, способных пропускать ток в обоих направлениях, разряжаться и заряжаться – плюсы и минус могут меняться. В аккумуляторе катод положительный во время разрядки и отрицательный при зарядке. Для правильного использования приборов и элементов важно помнить одно: у всех потребителей энергии – электронных деталей, электролизеров, гальванических батарей − вывод, подключаемый к плюсу, называется анодом.
как определить где плюс, а где минус?
Известно, что светодиод в рабочем состоянии пропускает ток только в одном направлении. Если его подключить инверсионно, то постоянный ток через цепь не пройдет, и прибор не засветится. Происходит это потому, что по своей сущности прибор является диодом, просто не каждый диод способен светиться. Получается, что существует полярность светодиода, то есть он чувствует направление движения тока и работает только при определенном его направлении.
Получается, что существует полярность светодиода, то есть он чувствует направление движения тока и работает только при определенном его направлении.
Определить полярность прибора по схеме не составит труда. Светодиод обозначают треугольником в кружке. Треугольник упирается всегда в катод (знак «−», поперечная черточка, минус), положительный анод находится с противоположной стороны.
Но как определить полярность, если вы держите в руках сам прибор? Вот перед вами маленькая лампочка с двумя выводами-проводками. К какому проводку подключать плюс источника, а к какому минус, чтобы схема заработала? Как правильно установить сопротивление где плюс?
Определяем зрительно
Первый способ – визуальный. Предположим, вам необходимо определить полярность абсолютно нового светодиода с двумя выводами. Посмотрите на его ножки, то есть выводы. Один из них будет короче другого. Это и есть катод. Запомнить, что это катод можно по слову «короткий», поскольку оба слова начинаются на буквы «к». Плюс будет соответствовать тому выводу, который длиннее. Иногда, правда, на глаз определить полярность сложновато, особенно когда ножки согнуты или поменяли свои размеры в результате предыдущего монтажа.
Плюс будет соответствовать тому выводу, который длиннее. Иногда, правда, на глаз определить полярность сложновато, особенно когда ножки согнуты или поменяли свои размеры в результате предыдущего монтажа.
Глядя в прозрачный корпус, можно увидеть сам кристаллик. Он расположен как будто в маленькой чашечке на подставке. Вывод этой подставки и будет катодом. Со стороны катода также можно увидеть небольшую засечку, как бы срез.
Но не всегда эти особенности заметны у светодиода, поскольку некоторые производители отходят от стандартов. К тому же есть много моделей, изготовленных по другому принципу. На сложных конструкциях сегодня производитель ставит значки «+» и «−», делают отметку катода точкой или зеленой линией, чтобы все было предельно понятно. Но если таких отметок нет по каким-то причинам, то на помощь приходит электрическое тестирование.
Применяем источник питания
Более эффективный способ определить полярность – подключить светодиод к источнику питания. Внимание! Выбирать надо источник, напряжение которого не превышает допустимое напряжение светодиода.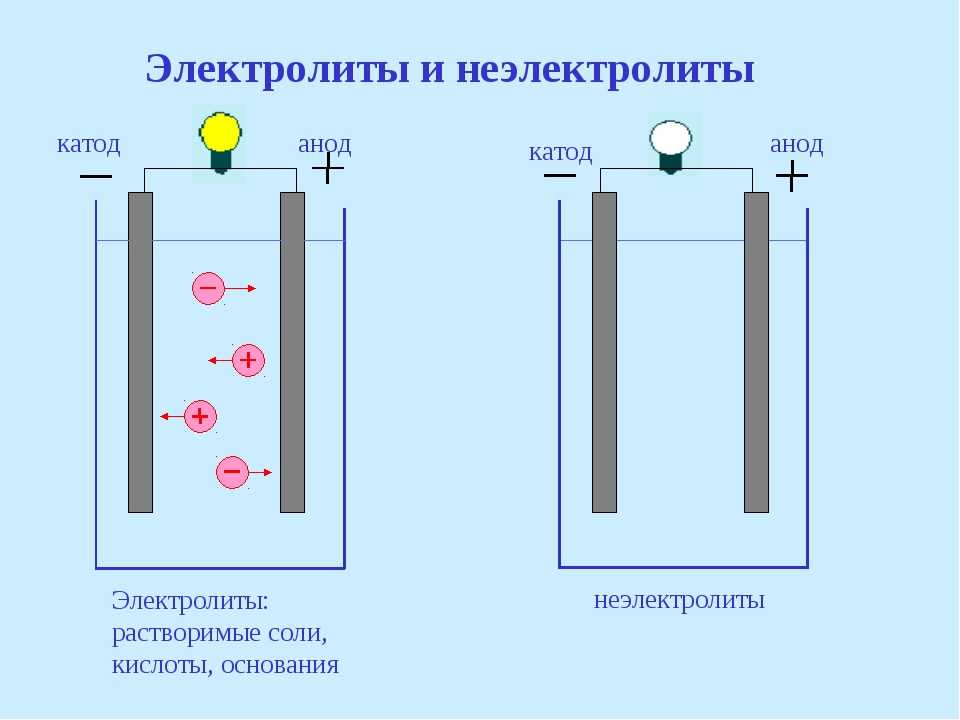 Можно соорудить самодельный тестер, используя обычную батарейку и резистор. Это требование связано с тем, что при обратном подключении светодиод может перегореть или ухудшить свои световые характеристики.
Можно соорудить самодельный тестер, используя обычную батарейку и резистор. Это требование связано с тем, что при обратном подключении светодиод может перегореть или ухудшить свои световые характеристики.
Некоторые говорят, что подключали светодиод и так и сяк, и он от этого не портился. Но все дело в предельном значении обратного напряжения. К тому же, лампочка может сразу и не погаснуть, но срок ее работы уменьшится, и тогда ваш светодиод проработает не 30-50 тысяч часов, как указано в его характеристиках, а в несколько раз меньше.
Если мощности элемента питания для светодиода не хватает, и прибор не светится, как вы его не подключаете, то можно соединить несколько элементов в батарею. Напоминаем, сто элементы соединяются последовательно плюс к минусу, а минус к плюсу.
Применение мультиметра
Существуют прибор, который называется мультиметром. Его с успехом можно использовать, чтобы узнать, куда подключать плюс, а куда минус. На это уходит ровным счетом одна минута.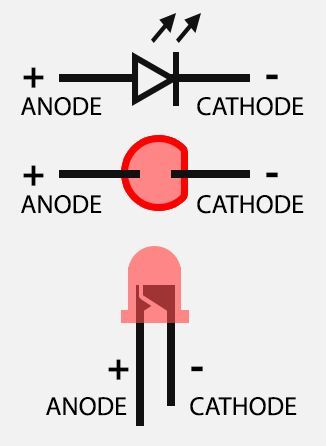 В мультиметре выбирают режим измерения сопротивления и прикасаются щупами к контактам светодиода. Красный провод указывает на подключение к плюсу, а черный – к минусу. Желательно, чтобы касание было кратковременным. При обратном включении прибор ничего не покажет, а при прямом включении (плюс к плюсу, а минус к минусу) прибор покажет значение в районе 1,7 кОм.
В мультиметре выбирают режим измерения сопротивления и прикасаются щупами к контактам светодиода. Красный провод указывает на подключение к плюсу, а черный – к минусу. Желательно, чтобы касание было кратковременным. При обратном включении прибор ничего не покажет, а при прямом включении (плюс к плюсу, а минус к минусу) прибор покажет значение в районе 1,7 кОм.
Можно также включать мультиметр на режим проверки диода. В этом случае при прямом включении светодиодная лампочка будет светиться.
Данный способ самый эффективный для лампочек, излучающих красный и зеленый свет. Светодиод, дающий синий или белый свет рассчитан на напряжение, большее 3 вольт, поэтому не всегда при подключении к мультиметру он будет светиться даже при правильной полярности. Из этой ситуации можно легко выйти, если использовать режим определения характеристик транзисторов. На современных моделях, таких как DT830 или 831, он присутствует.
Диод вставляют в пазы специальной колодки для транзисторов, которая обычно расположена в нижней части прибора. Используется часть PNP (как для транзисторов соответствующей структуры). Одну ножку светодиода засовывают в разъем С, который соответствует коллектору, вторую ножку – в разъем Е, соответствующий эмиттеру. Лампочка засветится, если катод (минус), будет подключен к коллектору. Таким образом, полярность определена.
Используется часть PNP (как для транзисторов соответствующей структуры). Одну ножку светодиода засовывают в разъем С, который соответствует коллектору, вторую ножку – в разъем Е, соответствующий эмиттеру. Лампочка засветится, если катод (минус), будет подключен к коллектору. Таким образом, полярность определена.
электрохимия — Что такое анод и что такое катод?
Задавать вопрос
спросил
Изменено
9 месяцев назад
Просмотрено
106 тысяч раз
$\begingroup$
Возможно (надеюсь) простой вопрос об обозначениях «анод» и «катод». На изображении ниже представлена схема полимерного солнечного элемента (Источник (WBM)).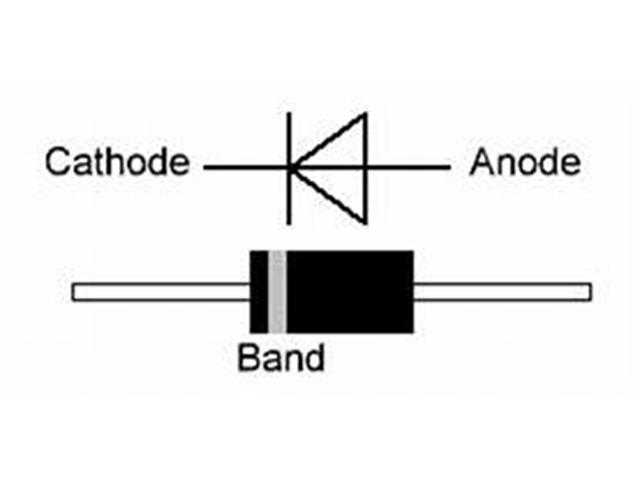 (Текст рисунка также цитируется для контекста).
(Текст рисунка также цитируется для контекста).
У меня вопрос только по наименованию электродов. Не правда ли, что
- катод является восстановительным электродом, который поставляет электрона, а
- анод окислитель 9Электрод 0023, который принимает электрона?
Почему электроны (черные сферы) движутся к отрицательно заряженному катоду, а положительные дырки (белые сферы) движутся к положительно заряженному аноду, поглощающему электроны? Разве обратное не имеет смысла?
Это ошибка на чертеже или я должен переосмыслить свое понимание терминов «анод» и «катод»?
Рис. 1. Принцип работы солнечной батареи. Свет входит в ячейку через прозрачный анод и поглощается в объемном слое гетероперехода за счет генерации экситонов (1). Экситоны диффундируют в объемном гетеропереходе до тех пор, пока либо рекомбинируют, либо достигают донорно-акцепторной границы раздела, где они разделяются на электроны (черные) и дырки (белые) (2).
Затем электроны и дырки будут перемещаться к соответствующим аноду и катоду через фазу донорного и акцепторного материала (3).
Редактировать
Если цифра верна, а меня запутали, то есть несколько других случаев, которые, кажется, учат ложно. Например. Следующее правило «ПАНИКИ» для запоминания, что является катодом, а что анодом (из этого источника, слайд 8):
«*Отрицательный — это катод», — говорится в нем, и мы возвращаемся к моему вопросу в вверху: почему электроны (черные сферы) движутся к отрицательному катоду на этой схеме?
Многие другие диаграммы, соответствующие этой последней, можно найти с помощью простого поиска в Google.
- электрохимия
- редокс
- номенклатура
- электроны
$\endgroup$
4
$\begingroup$
Независимо от полярности электрод, на котором происходит окисление, называется анодом, поэтому восстановление должно происходить на катоде.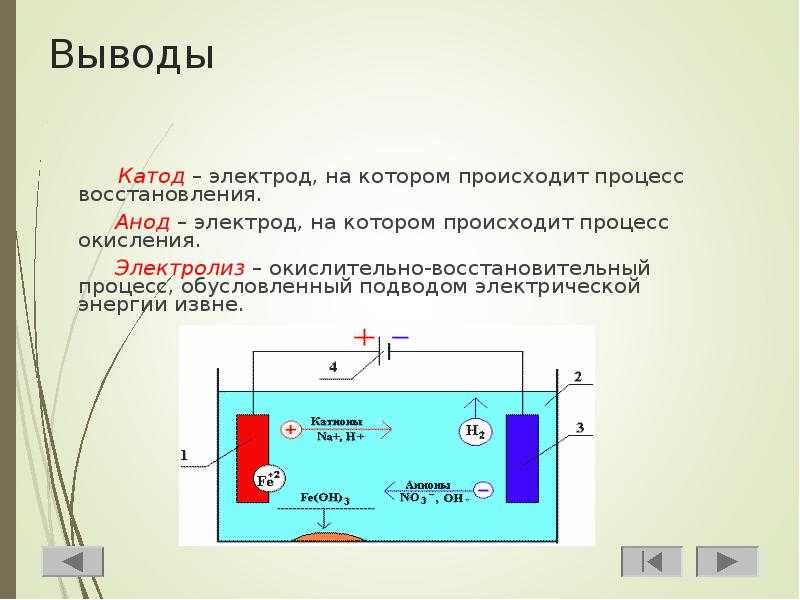 {2+}}$, электроны высвобождаются в металл и по проволоке текут к серебряному электроду. Цинковый электрод является анодом, а серебряный — катодом.
{2+}}$, электроны высвобождаются в металл и по проволоке текут к серебряному электроду. Цинковый электрод является анодом, а серебряный — катодом.
$\endgroup$
$\begingroup$
В электрохимической ячейке нет законченной электронной схемы
В электрохимической ячейке анод является источником электронов для внешней цепи, а катод — приемником. Цепь переноса заряда замыкается ионами, перемещающимися внутри клетки. Солнечный элемент отличается от электрохимического элемента тем, что в них нет чистой химической реакции. В солнечном элементе электроны текут по замкнутому контуру — по кругу во внешнем контуре и через устройство.
Обозначение анода и катода
Таким образом, обозначение анода и катода основывается на аналогии между гальваническим элементом и фотогальваническим элементом как источником электрической работы. Имеет смысл использовать направление потока электронов во внешней цепи для определения анода и катода (электроны движутся от анода к катоду во внешней цепи). В гальванической ячейке внутри ячейки нет потока электронов (вместо этого есть поток ионов для балансировки зарядов). В фотогальваническом элементе электроны текут от перехода к аноду, а дырки текут от перехода к катоду (или можно сказать, что электроны текут от катода к переходу).
В гальванической ячейке внутри ячейки нет потока электронов (вместо этого есть поток ионов для балансировки зарядов). В фотогальваническом элементе электроны текут от перехода к аноду, а дырки текут от перехода к катоду (или можно сказать, что электроны текут от катода к переходу).
К сожалению, анод и катод называются по-разному в зависимости от типа устройства, см. этот обзор (и помните, что ток I иногда идет в том же направлении, что и электроны, а иногда нет, опять же в зависимости от соглашений).
Отрицательный и положительный электрод
Обозначения (+) и (-) сбивают с толку даже только для гальванических элементов. В то время как обозначение анода и катода одинаково для гальванических и электролитических элементов (т. Е. Использование и зарядка батареи), обозначение (+) и (-) переключается, поэтому оно не связано с направлением движения электронов по внешнему проводу.
Направление потока электронов
Для фотогальванического элемента может помочь следующая картинка: до того, как свет попадает на элемент, анод и катод не являются ни отрицательными, ни положительными.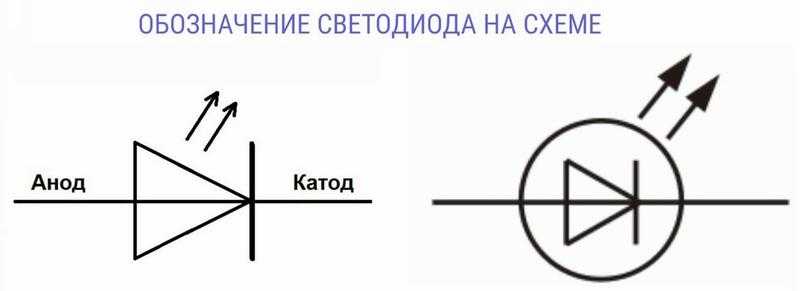 Как только свет попадает на ячейку, анод становится отрицательным, потому что электроны движутся к нему от перехода, а катод становится положительным, потому что электроны прыгают с него в дырки, идущие от перехода. Если затем подключить внешний потребитель электрической работы, можно предсказать направление потока электронов через внешнюю цепь.
Как только свет попадает на ячейку, анод становится отрицательным, потому что электроны движутся к нему от перехода, а катод становится положительным, потому что электроны прыгают с него в дырки, идущие от перехода. Если затем подключить внешний потребитель электрической работы, можно предсказать направление потока электронов через внешнюю цепь.
$\endgroup$
$\begingroup$
Анод представляет собой электрод, на котором вещества теряют электроны и окисляются .
Катод — это электрод, на котором вещества приобретают электроны и восстанавливаются .
Сложность запоминания заключается в том, что аноды и катоды меняют положение , когда ток меняется на противоположный, в зависимости от того,
- ячейка находится в режиме электролиза
- ячейка находится в режиме обеспечения тока.

Для первичных и вторичных (перезаряжаемых) элементов принято использовать последний в качестве источника питания.
Мой мнемотехнический трюк состоит в том, чтобы помнить, что
На аноде происходит анабазис (*) электронов, вверх от электрода, т.е. окисление.
Это означает, что анод
положительный электрод при электролизе,(=прилагается + провод от внешнего источника питания, отводящий электроны . Это не обязательно означает, что он имеет более положительный потенциал, чем катод),
отрицательный электрод в ячейке питания (минусовой электрод ячейки, обеспечивающий электроны ).
На катоде происходит катабазис электронов, вниз к электроду, т.е. восстановление.
Это означает катод
- отрицательный электрод при электролизе, принимающий электроны от внешнего источника питания.

- положительный электрод для элементов питания. вытягивает электроны из схемы.
(*) Анабасис Ксенофонта, около 370 г. до н.э., «Путешествие вверх», о драматическом возвращении греческих наемников из Персии в Грецию.
$\endgroup$
$\begingroup$
Вы запутались в определениях восстановления и окисления.
- Восстановление – это присоединение электронов.
- Окисление – это потеря электронов.
Это означает, что катод получает электроны, а анод теряет электроны. Иллюстрация абсолютно правильная.
$\endgroup$
3
$\begingroup$
Катод — это электрод, на котором происходит восстановление, а Анод — это электрод, на котором происходит окисление.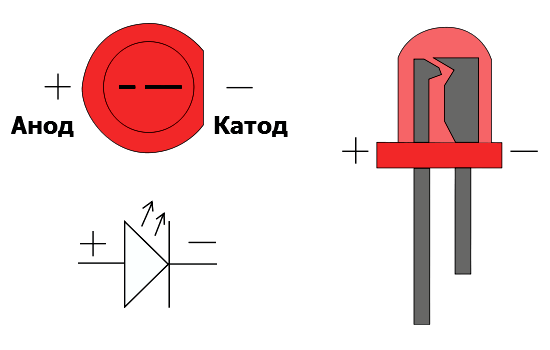
I Используйте Mnemonic Масляная установка
Окивание -> Потеря электронов (или увеличение состояния окисления)
Снижение -> усиление электронов (или устранение в кислороде).
$\endgroup$
1
$\begingroup$
На приведенном выше рисунке изображена внутренняя часть силового устройства, т. е. солнечного элемента. Это можно считать батареей. На рисунке ниже положительные заряды проходят через металл и достигают катода батареи. Тем временем внутри батареи отрицательные заряды движутся к катоду, чтобы нейтрализовать положительные заряды, исходящие от металлических электродов.
Таким образом, внешние положительные заряды движутся к катоду, а внутренние отрицательные заряды движутся к катоду. Следовательно, все представленные изображения соответствуют действительности.
$\endgroup$
$\begingroup$
Катод — положительный электрод; анод является отрицательным электродом.
Во время разряда положительные ионы перетекают от анода к катоду. Это делает катод положительно заряженным. Свободные электроны на аноде текут наружу через нагрузку к катоду. Во время заряда внешний источник напряжения имеет положительный электрод, подключенный к катоду, и его отрицательный электрод, подключенный к аноду. Отрицательный электрод внешнего источника напряжения подает электроны на анод. Избыточные положительные ионы на катоде отталкиваются к аноду, но движутся медленнее, чем электроны движутся по проводам.
$\endgroup$
Зарегистрируйтесь или войдите в систему
Зарегистрируйтесь с помощью Google
Зарегистрироваться через Facebook
Зарегистрируйтесь, используя электронную почту и пароль
Опубликовать как гость
Электронная почта
Требуется, но никогда не отображается
Опубликовать как гость
Электронная почта
Требуется, но не отображается
Нажимая «Опубликовать свой ответ», вы соглашаетесь с нашими условиями обслуживания, политикой конфиденциальности и политикой использования файлов cookie
.
электрохимия — Почему электродный потенциал катода положительный?
спросил
Изменено
3 месяца назад
Просмотрено
3к раз
$\begingroup$
Потенциал электрода – это разность потенциалов между электродом и окружающим электролитом.
Если потенциал катода положительный, это означает, что потенциал электрода больше, чем потенциал электролита, а это означает, что электроны будут течь из электролита к катоду.
А не должно ли быть наоборот? разве электроны не должны течь от катода к электролиту, что означает, что потенциал электрода должен быть отрицательным?
Точно так же мы можем сказать, что электродный потенциал для анода положителен.
Кто-нибудь может указать на ошибки в этом рассуждении?
- электрохимия
$\endgroup$
6
$\begingroup$
Я думаю, что причиной вашей путаницы являются названия катод и анод. Анод и катоды не имеют никакого отношения к электростатическому знаку. Они связаны с процессами.
Катод, независимо от того, является ли он электростатически положительным ИЛИ отрицательным, представляет собой электрод, на котором происходит восстановление.
Анод, независимо от того, является ли он электростатически положительным ИЛИ отрицательным, представляет собой электрод, на котором происходит окисление.
Надеюсь, это проясняет ваше замешательство по поводу знаков.
Потенциал электрода — это разность потенциалов между электродом и окружающим электролитом.
Это не электродный потенциал, а скорее межфазная разность потенциалов.
Мэтью хотел уточнить это дальше: «Потенциал электрода НЕ является разностью потенциалов между электродом и окружающим электролитом». Я думаю, что это несбывшаяся мечта электрохимика найти абсолютную разность потенциалов, то есть мы погружаем медный электрод в раствор меди и измеряем разность потенциалов между ними. Я думаю, что можно импровизировать то, что говорит Путник. табличные электродные потенциалы, встречающиеся обычно, не являются разностью потенциалов металлов и их растворов. Причина в том, что измерить такую гипотетическую конструкцию невозможно.
$\endgroup$
3
$\begingroup$
Потенциал электрода равен , а НЕ разности потенциалов между электродом и окружающим электролитом.
Потенциал электрода условно представляет собой относительный потенциал эталонного эталонного водородного электрода (СТЭ) с условно присвоенным потенциалом 0 В.
Тогда «абсолютный» потенциал СТЭ относительно потенциала свободных электронов оценивается как \pm 0,02 В}$.
Катоды более отрицательные, чем аноды в гальванических элементах, и более положительные, чем аноды в гальванических элементах. Но более положительное не означает положительное, а более отрицательное не означает отрицательное. Условие маркировки положительных и отрицательных контактов ячейки достаточно хорошо для повседневной жизни, но ничего не говорит о знаке электродных потенциалов (либо относительно свободного электрона в вакууме, либо относительно SHE).
Потенциалы электродов могут быть положительными + отрицательными, или обоими положительными или обоими отрицательными относительно SHE. Они всегда положительны относительно свободного электрона.
$\endgroup$
11
$\begingroup$
Вопрос: Почему электродный потенциал для катода положительный?
Так как вопрос не касался какой ячейки, то ответ не всегда положительный:
Как пояснил М. Фарук, катод – это место, где в клетке происходит восстановление. Таким образом, в гальванической ячейке она положительна, так как происходит реакция восстановления $\ce{Y+ + e- -> Y}$. Необходимые для этого электроны исходили от анода. Однако в электролитической ячейке электроны из внешнего источника (например, батареи) текут к отрицательному концу, где происходит реакция восстановления $\ce{M+ + e- -> M}$. Таким образом, катод здесь отрицательный.
Фарук, катод – это место, где в клетке происходит восстановление. Таким образом, в гальванической ячейке она положительна, так как происходит реакция восстановления $\ce{Y+ + e- -> Y}$. Необходимые для этого электроны исходили от анода. Однако в электролитической ячейке электроны из внешнего источника (например, батареи) текут к отрицательному концу, где происходит реакция восстановления $\ce{M+ + e- -> M}$. Таким образом, катод здесь отрицательный.
Редактировать: Я согласен с комментарием Poutnik ниже. Соответственно, может быть лучше сказать, что катоды более отрицательные, чем аноды в гальванических элементах, и более положительные, чем аноды в гальванических элементах. Поскольку более положительное не означает положительное, а более отрицательное не означает отрицательное. Условие маркировки положительных и отрицательных контактов клеток достаточно хорошо для повседневной жизни, но оно ничего не говорит о знаке электродных потенциалов ни по отношению к свободному электрону, ни к SHE (например, соответствующий потенциал реакции восстановления полуклетки может нести положительный или отрицательный знак, основанный на соответствующей реакции).
$\endgroup$
4
$\begingroup$
Я думаю, что ACchem отлично объясняет значение катода и анода. (Это связано с происходящим процессом, а не с электростатическим потенциалом).
Анод всегда дает электроны (окисление).
Катод всегда принимает электроны (восстановление).
Положительный электрод — это электрод с высоким уровнем er потенциал, чем отрицательный электрод. Поскольку все потенциалы определены относительно теоретического стандартного электрода (см. ответ Путника), это обозначение может соответствовать или не соответствовать фактическому знаку потенциала.
Когда реакция протекает самопроизвольно (гальванический элемент), отрицательный электрод является анодом. Электроны текут от отрицательного электрода к положительному электроду.
Когда реакция должна управляться внешним источником энергии (электролитической ячейкой), отрицательный электрод является катодом.
 Затем электроны и дырки будут перемещаться к соответствующим аноду и катоду через фазу донорного и акцепторного материала (3).
Затем электроны и дырки будут перемещаться к соответствующим аноду и катоду через фазу донорного и акцепторного материала (3).