Содержание
Как определить полярность кабеля? Простые способы определить плюс или минус.
Ни для кого не секрет, что знание полярности очень важно при подключении электроприборов. Нельзя подключать электроаппаратуру с нарушением полярности, она не только не будет работать, но и может выйти из строя. Конечно, чаще всего полярность обозначается символами
«+» и «-» или с помощью цветовой маркировки: красный (плюс) и черный (минус).
Но что же делать, если провода одинакового цвета или на них нет никакой маркировки?
Обращаемся за помощью к нашему любимому мультиметру.
Теперь Вы понимаете, почему мы настоятельно советовали его приобрести в нашей предыдущей статье: «Какие инструменты нужны для проведения электромонтажных работ дома? Собираем ящик электрика».
А теперь переходим к самой любимой части работы с мультиметром, когда происходит настоящее волшебство. Допустим, у мы хотим определить полярность контактов зарядки ноутбука, и мы хотим припаять контакты.
- Вставляем черный провод в гнездо «COM», а красный – в гнездо со значком «HzV». Рычажок на мультиметре устанавливаем в положение измерения постоянного напряжения с порогом 20 В.
- Включаем в сеть зарядное устройство, красным и черным щупом касаемся до контактов разъёма (конечно, не замыкая их между собой одним щупом! Мы ведь не хотим ничего поломать. Только полярность определим — и всё!)
- Если Вы прикоснулись КРАСНЫМ щупом к ПЛЮСУ, то на мультиметре появится ПОЛОЖИТЕЛЬНОЕ значение.
- Или же обратная ситуация: на мультиметре появилось отрицательное значение. Значит, красный щуп находится в контакте с минусом.
Также есть любимая нами «умная» индикаторная отвертка, которая в некоторых случаях тоже может помочь определить полярность. Но, чтобы лишний раз не обнадеживать Вас этим способом, советуем лишь действовать точно по инструкции, приложенной к индикаторной отвертке.
Но вот представьте ситуацию: стоите Вы в чистом поле, ящик электрика оказался по чистой случайности сегодня забыт дома, а Вам именно сейчас нужно определить полярность контактов прибора в машине. И тут тихий голос специалиста 220.ru шепчет Вам: «Найди картошку…», нет, Вы не сошли с ума, и мы тоже!
И тут тихий голос специалиста 220.ru шепчет Вам: «Найди картошку…», нет, Вы не сошли с ума, и мы тоже!
Это еще один способ определить полярность контактов с помощью подручных средств.
- Берем сырой картофель (эксперты 220.ru предупреждают, что с запеченной картошкой на шашлыках это не получится).
- Разрезаем картофель пополам. Не бросаем эту затею. Следующий шаг уже приведет нас к победе.
- Подключаем необходимый прибор и вставляем контакты в несчастную картошку, которая именно сегодня служит нашим спасителем.
- Ждем 10-15 минут. На том месте, где находился плюс, появится светло-зеленое пятно, а где минус – ничего.
Но вот Вы обнаружили, что картошки не оказалось, а лезть выкапывать картошку у местных как-то некрасиво, да и чревато последствиями. Для другого способа Вам понадобится лужа или речка. Да-да, это не ошибка, и мы не издеваемся над Вами.
- Наливаем воду в стакан, кружку (хорошо бы не металлическую и будет отлично, если вода будет теплой).
- Подключаем наш прибор, опускаем контакты в воду. Приглядитесь. Что Вы видите? И не надо говорить, что Вы видите сумасшедшего, который поверил нам и стоит с кружкой воды из лужи посреди поля.
- То, что Вы видите, называется электролиз воды. Из воды вокруг минусового контакта начинают выделяться пузырьки водорода. Хотим заметить, что анод тоже «пузырится», просто пузырьков меньше в два раза. Поэтому не стоит думать, что у Вас двоится в глазах после всех проведенных опытов.
Самое важное: стоит помнить, что с переменным током опыты с картошкой и водой не будут работать. Для того чтобы определить фазу и ноль, Вам лучше ознакомиться со следующими публикациями:
- «Как пользоваться индикаторной отверткой и мультиметром для определения фазы и ноля?»
- «Определение фазы и ноля без приборов.
 Цветовая маркировка проводов.»
Цветовая маркировка проводов.»
Авторский материал. Копирование полностью или частично разрешено только при наличии активной (кликабельной) ссылки на эту страницу и указании источника: «сайт 220.ru».
Главные ошибки при оцинковке кузова автомобиля своими силами — Лайфхак
- Лайфхак
- Эксплуатация
Фото vesta-site.ru
Оцинковка кузова автомобиля — самая результативная технология борьбы с коррозией, позволяющая практически без последствий эксплуатировать авто в самых неблагоприятных условиях. Правда, весьма дорогостоящая. Не мудрено поэтому, что владельцы подержанных авто, особенно тех, что уже «зацвели», предпочитают проводить эту процедуру самостоятельно. Но, как правило, без особого успеха. Почему, и как правильно цинковать машину в домашних условиях, разобрался портал «АвтоВзгляд».
Дмитрий Цыпкин
При самостоятельном кузовном ремонте заботливый водитель предпочитает покрыть чем-нибудь голый металл перед покраской. И выбор, как правило, падает на «что-нибудь с цинком». Однако мло кто знает, что на рынке сегодня ничтожно мало специальных составов для настоящего цинкования. В магазинах автовладельцу чаще всего впаривают грунты с, якобы, цинком, и невероятными преобразователями ржавчины в цинк. Все это мало относится к настоящему цинкованию.
И выбор, как правило, падает на «что-нибудь с цинком». Однако мло кто знает, что на рынке сегодня ничтожно мало специальных составов для настоящего цинкования. В магазинах автовладельцу чаще всего впаривают грунты с, якобы, цинком, и невероятными преобразователями ржавчины в цинк. Все это мало относится к настоящему цинкованию.
НАПРАСНЫЕ СЛОВА…
Итак, на вашем автомобиле появился расползающийся «жучок» ржавчины. В случае с подержанными авто — ситуация частая, особенно в районе порогов и колесных арок. Обычно эти места просто зачищают от рыхлой ржавчины, смачивают каким-нибудь преобразователем, наносят грунт и краску. Какое-то время все нормально, а потом ржа вылезает вновь. Как же так? Ведь при подготовке использовали преобразователь ржавчины в цинк! По крайней мере, что-то такое было написано на этикетке.
На самом деле все подобные препарата сделаны на основе ортофосфорной кислоты и максимум, что может подобный состав — фосфатировать поверхность, причем это будет пористое фосфатирование, которое в дальнейшем заржавеет. Получившаяся пленка не может использоваться как самостоятельная защита — только лишь под покраску. Соответственно, если краска некачественная, либо просто слезла — этот слой не защитит от коррозии.
Получившаяся пленка не может использоваться как самостоятельная защита — только лишь под покраску. Соответственно, если краска некачественная, либо просто слезла — этот слой не защитит от коррозии.
Фото a.d-cd.net
ЧТО ВЫБРАТЬ?
На полках наших магазинов есть и реальные составы для самостоятельного цинкования, причем двух видов — для холодного цинкования (это процесс еще называют цинкирование) и для гальванического (в комплекте обычно идут и электролит, и анод), но стоят они на порядок дороже преобразователей. Холодное цинкование в расчет не берем, его изначально придумали для покрытия металлоконструкций, оно неустойчиво к органическим растворителям и механическим повреждениям. Нас интересует гальванической способ нанесения цинка, при этом все необходимое для этого процесса можно сделать дома. Итак, понадобится для того, чтобы оцинковать участок кузова?
Прежде чем приступить — следует помнить про соблюдение техники безопасности при работе с реактивами: использовать респираторную маска, резиновые перчатки, защитные очки, а все манипуляции проводить на открытом воздухе или в хорошо проветриваемом помещении.
ПЛЮС КИПЯТОК
Этап первый. Подготовка металла. Поверхность стали должна быть полностью зачищена от ржавчины и краски. Цинк на ржавчину не ложится, на краску — тем более. Используем наждачную бумагу или специальные насадки на дрель. Малогабаритную деталь проще всего прокипятить в 10-процентном (100 грамм кислоты на 900 мл воды) растворе лимонной кислоты до полного уничтожения ржавчины. Затем поверхность обезжирить.
Этап второй. Подготовка электролита и анода. Гальванический процесс цинкования таков. В растворе электролита (электролит служит проводником вещества) цинковый анод (то есть плюс) передает цинк на катод (то есть минус). В Сети бродит множество рецептов электролита. Самый простой — использовать соляную кислоту, в которой растворяют цинк.
Фото vash-avtomaster.narod.ru
Кислоту можно купить в магазине химических реактивов, либо в хозяйственном. Цинк — в том же магазине химреактивов, либо приобрести обычные солевые батарейки и извлечь из них корпус — он сделан из цинка. Цинк нужно растворять до тех пор, пока он не перестанет реагировать. При этом выделяется газ, так что все манипуляции, повторимся, нужно проводить на улице или в хорошо проветриваемом помещении.
Цинк нужно растворять до тех пор, пока он не перестанет реагировать. При этом выделяется газ, так что все манипуляции, повторимся, нужно проводить на улице или в хорошо проветриваемом помещении.
Электролит посложнее делается таким образом — в 62 миллилитрах воды растворяем 12 граммов хлористого цинка, 23 грамма хлористого калия и 3 грамма борной кислоты. Если нужно больше электролита, ингредиенты нужно увеличивать пропорционально. Подобные реактивы проще всего взять в специальном магазине.
МЕДЛЕННО И ПЕЧАЛЬНО
Этап третий. У нас есть полностью подготовленная поверхность — очищенный и обезжиренный металл, анод в виде цинкового корпуса от батарейки, электролит. Обернем анод ватным диском, либо ватой, либо сложенной в несколько слоев марлей. Подключим анод к плюсу автомобильного аккумулятора через провод подходящей длины, а минус к кузову автомобиля. Обмакнем вату на аноде в электролит так, чтобы она пропиталась. Теперь медленными движениями начинаем водить по голому металлу.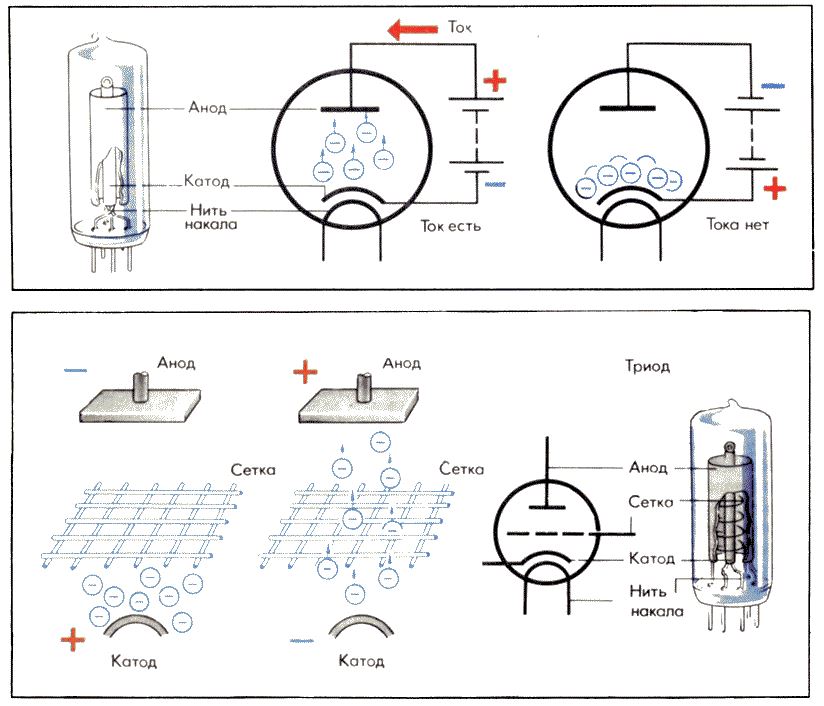 На нем должно появиться серое покрытие.
На нем должно появиться серое покрытие.
Фото mir-auto24.ru
В ЧЕМ ОШИБКА?
Если покрытие темное (а следовательно — хрупкое и пористое) — значит либо вы медленно водите анодом, либо слишком высокая плотность тока (в этом случае минус от аккумулятора отведите подальше), либо на вате подсох электролит. Равномерный серый налет не должен счищаться ногтем. Регулировать толщину покрытия придется на глаз. Таким образом можно нанести до 15—20 мкм покрытия. Скорость его разрушения примерно по 6 мкм в год при контакте с внешней средой.
В случае с деталью, ей нужно приготовить ванну (пластиковую или стеклянную) с электролитом. Процесс такой же — плюс на цинковый анод, минус на запчасть. Анод и запчасть следует поместить в электролит так, чтобы они не касались друг друга. Затем просто следите за осаждением цинка.
После того, как вы нанесли цинк, необходимо хорошо промыть место цинкования водой, чтобы убрать весь электролит. Не лишним будет перед покраской еще раз обезжирить поверхность. Таким образом детали или кузову можно продлить жизнь. Даже при разрушении внешнего слоя краски и грунта цинк не даст быстро заржаветь обработанному металлу.
Таким образом детали или кузову можно продлить жизнь. Даже при разрушении внешнего слоя краски и грунта цинк не даст быстро заржаветь обработанному металлу.
160407
- ГАИ
- Коррупция
Как вразумить нечестного стража порядка
401642
- ГАИ
- Коррупция
Как вразумить нечестного стража порядка
401642
Подпишитесь на канал «Автовзгляд»:
- Telegram
- Яндекс.Дзен
подержанные авто, автосервис, ремонт, техническое обслуживание, автохимия
Электролизеры
Электролитические
Ячейки
| Электролиз расплавленного NaCl | Электролиз водного NaCl |
| Электролиз воды | Фарадея Закон |
Гальванические элементы используют спонтанную химическую реакцию для запуска
электрический ток по внешней цепи. Эти клетки
Эти клетки
важно, потому что они являются основой для батарей, питающих
современное общество. Но они не единственный вид электрохимических
клетка. Также возможно построить ячейку, которая работает на
химическую систему, проводя электрический ток через
система. Эти клетки называются электролизеры .
Электролиз используется для запуска окислительно-восстановительной реакции в
направление, в котором это не происходит спонтанно.
Электролиз
Расплавленный NaCl
Идеальная ячейка для электролиза хлорида натрия
показано на рисунке ниже. Источником постоянного тока является
подключен к паре инертных электродов, погруженных в расплавленный натрий
хлористый. Поскольку соль нагревали до тех пор, пока она не растает, Na +
ионы текут к отрицательному электроду и Cl —
ионы текут к положительному электроду.
Когда ионы Na + сталкиваются с отрицательным электродом,
батарея имеет достаточно большой потенциал, чтобы заставить эти ионы
забрать электроны с образованием металлического натрия.
| Отрицательный электрод (катод) : | На + + Э — № |
Cl — ионы, сталкивающиеся с положительным электродом
окисляются до газа Cl 2 , который при этом
электрод.
| Положительный электрод (анод) : | 2 Кл — Класс 2 + 2 e — |
Чистый эффект прохождения электрического тока через
расплавленная соль в этой ячейке должна разлагать хлорид натрия на его
элементы, металлический натрий и газообразный хлор.
| Электролиз NaCl : | |||
| Катод (-): | На + + е — № | ||
| Анод (+): | 2 Кл — Класс 2 + 2 e — |
Потенциал, необходимый для окисления ионов Cl — до Cl 2
составляет -1,36 вольта, а потенциал, необходимый для восстановления Na +
ионов к металлическому натрию составляет -2,71 вольта. Аккумулятор, используемый для вождения
Аккумулятор, используемый для вождения
следовательно, эта реакция должна иметь потенциал не менее 4,07
вольт.
Этот пример объясняет, почему процесс называется электролизом .
Суффикс — lysis происходит от греческой основы, означающей
ослабить или разделить. Электролиз буквально использует электрический
тока для разделения соединения на его элементы.
| электролиз | ||
| 2 NaCl( л ) | 2 Na( л ) + Cl 2 ( г ) |
Этот пример также иллюстрирует разницу между гальваническими
ячейки и электролизеры. Вольтовы элементы используют энергию, переданную
выключен в спонтанной реакции на выполнение электрической работы. электролитический
клетки используют электрическую работу в качестве источника энергии для приведения в движение
реакция в обратном направлении.
Пунктирная вертикальная линия в центре рисунка выше
представляет собой диафрагму, удерживающую Cl 2 добытый газ
на аноде от контакта с металлическим натрием
генерируется на катоде. Функцию этой диафрагмы можно
понять, обратившись к более реалистичному рисунку
Показана коммерческая ячейка Даунса, используемая для электролиза хлорида натрия.
на рисунке ниже.
Газообразный хлор, образующийся на графитовом аноде, вставленном в
дно этой ячейки пузырится через расплавленный натрий
хлорида в воронку в верхней части ячейки. Металлический натрий, который
образуется на катоде, всплывает через расплавленный хлорид натрия
в натрий-сборное кольцо, из которого периодически
осушенный. Диафрагма, разделяющая два электрода, представляет собой
экран из железной сетки, предотвращающий взрывную реакцию,
произошло бы, если бы продукты реакции электролиза поступали
контакт.
Сырьем для ячейки Даунса является смесь 3:2 по массе
CaCl 2 и NaCl. Эта смесь используется, потому что она имеет
Эта смесь используется, потому что она имеет
температура плавления 580 o C, тогда как чистый хлорид натрия
должен быть нагрет более чем до 800 o C, прежде чем он расплавится.
Электролиз водных
NaCl
На рисунке ниже показан идеализированный рисунок клетки, в которой
водный раствор хлорида натрия подвергают электролизу.
И снова ионы Na + мигрируют в
отрицательный электрод и ионы Cl — мигрируют в сторону
положительный электрод. Но теперь есть два вещества, которые можно
на катоде восстанавливаются: ионы Na + и молекулы воды.
| Катод (-): | |||
| На + + е — № | E o красный = -2,71 В | ||
| 2 Н 2 О + 2 е — Н 2 + 2 ОХ — | E o красный = -0,83 В |
Поскольку восстановить воду намного проще, чем Na +
ионов, единственным продуктом, образующимся на катоде, является газообразный водород.
| Катод (-): | 2 H 2 O( l ) + 2 e — H 2 ( г ) + 2 OH — ( водный ) |
Существуют также два вещества, которые могут окисляться при
анод: Cl — ионов и молекул воды.
| Анод (+): | |||
| 2 Кл — Класс 2 + 2 e — | E o ox = -1,36 В | ||
| 2 Н 2 О O 2 + 4 H + + 4 e — | E o ox = -1,23 В |
Стандартные потенциалы для этих полуреакций таковы
близко друг к другу, что мы могли бы ожидать увидеть смесь Cl 2
и O 2 газ собирают на аноде. На практике единственным
На практике единственным
продукт этой реакции Cl 2 .
| Анод (+): | 2 Кл — Класс 2 + 2 e — |
На первый взгляд, окислять воду легче ( E o ox
= -1,23 В), чем ионы Cl — ( E o ox
= -1,36 вольта). Однако стоит отметить, что клетка
никогда не позволял достичь условий стандартного состояния. Решение
обычно 25% NaCl по массе, что значительно снижает
потенциал, необходимый для окисления Cl — ион. рН
ячейка также поддерживается очень высокой, что снижает окисление
потенциал для воды. Решающим фактором является явление, известное как
перенапряжение , дополнительное напряжение, которое должно быть
применяется к реакции, чтобы заставить ее происходить с той скоростью, с которой она
имело бы место в идеальной системе.
В идеальных условиях потенциал 1,23 вольта большой
достаточно для окисления воды до газа O 2 . Под реальным
условиях, однако, может потребоваться гораздо большее напряжение для
инициировать эту реакцию. (перенапряжение для окисления
воды может достигать 1 вольта.) Тщательно выбирая
электрод для максимального перенапряжения для окисления воды
а затем тщательно контролируя потенциал, при котором клетка
работает, мы можем гарантировать, что в этом
реакция.
Таким образом, электролиз водных растворов натрия
хлорид не дает таких продуктов, как электролиз расплавленного
хлорид натрия. Электролиз расплавленного NaCl разлагает это
складывается из его элементов.
| электролиз | ||
| 2 NaCl( л ) | 2 Na( l ) + Cl 2 ( г ) |
Электролиз водных растворов NaCl дает смесь
газообразный водород и хлор и водный раствор гидроксида натрия
решение.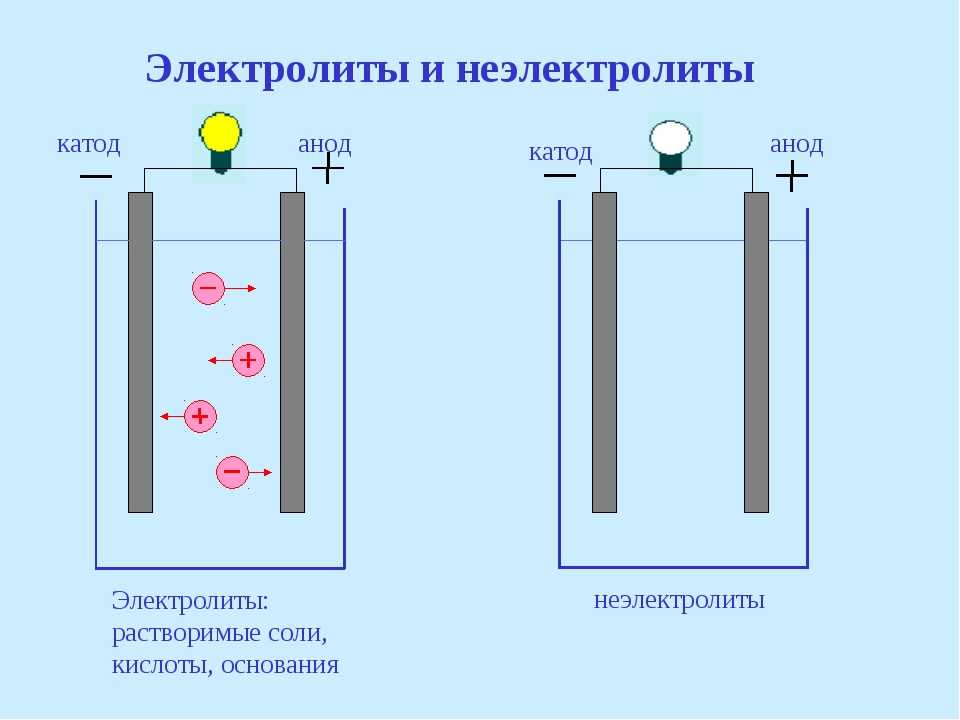
| электролиз | ||
| 2 NaCl( водн. ) + 2 H 2 O( л ) | 2 На + ( водный раствор ) + 2 OH — ( водный раствор ) + H 2 ( г ) + Cl 2 ( г ) |
Поскольку спрос на хлор намного превышает спрос
для натрия электролиз водного хлорида натрия является более
важный коммерческий процесс. Электролиз водного раствора NaCl
Решение имеет еще два преимущества. Он производит газ H 2 .
на катоде, который можно собирать и продавать. Он также производит
NaOH, который можно слить со дна электролизера.
клетка и продана.
Вертикальная пунктирная линия на приведенном выше рисунке представляет
диафрагма, предотвращающая образование Cl 2 на аноде
в этой клетке от контакта с NaOH, который
накапливается на катоде. При снятии этой диафрагмы с
При снятии этой диафрагмы с
клетка, продукты электролиза водного раствора натрия
хлорид реагирует с образованием гипохлорита натрия, который является первым
шаг в приготовлении гипохлоритных отбеливателей, таких как
Хлорокс.
Cl 2 ( г ) + 2 OH — ( водный раствор )
Cl — ( aq ) + OCl — ( aq ) + H 2 O( l )
Electrolysis of Water
A standard apparatus for the electrolysis воды показано в
рисунок ниже.
| электролиз | ||
| 2 H 2 O( л ) | 2 H 2 ( г ) + O 2 ( г) |
Пара инертных электродов запаяна на противоположных концах
контейнер для сбора H 2 и O 2
газ, выделяющийся в этой реакции.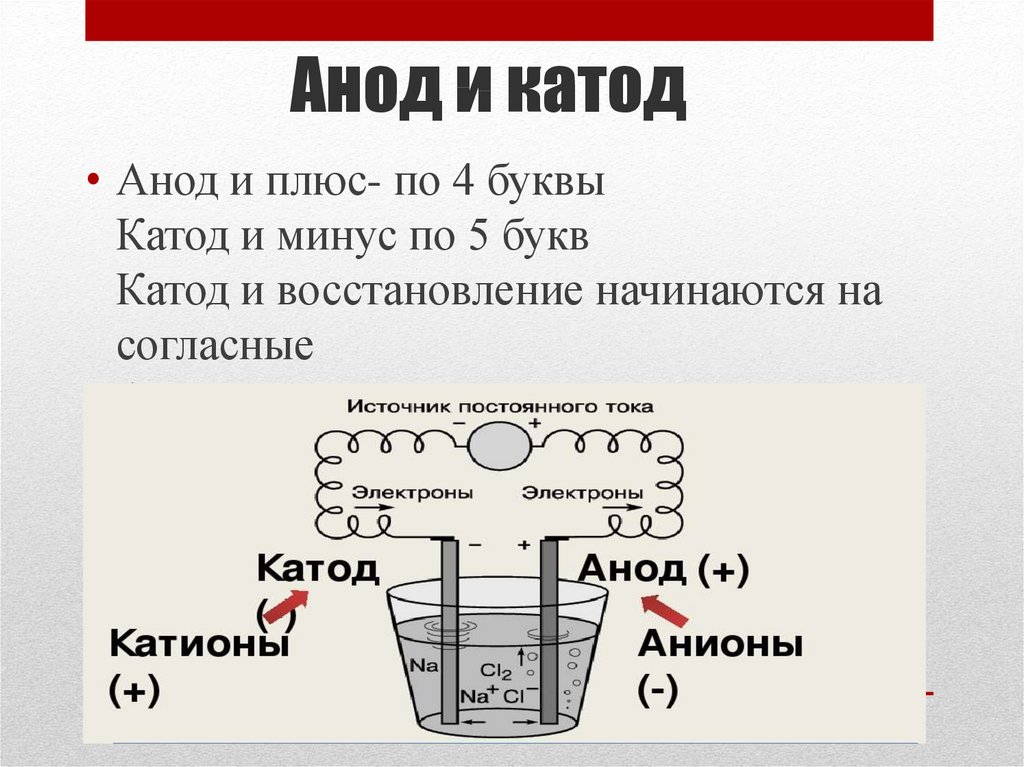 Затем электроды соединяются
Затем электроды соединяются
к батарее или другому источнику электрического тока.
Вода сама по себе является очень плохим проводником электричества. Мы
поэтому добавьте в воду электролит, чтобы получить ионы, которые могут
протекать через раствор, тем самым завершая электрический
схема. Электролит должен быть растворим в воде. Это также должно
быть относительно недорогим. Самое главное, он должен содержать ионы
которые труднее окислять или восстанавливать, чем воду.
| 2 H 2 O + 2 e — Н 2 + 2 ОХ — | E o красный = -0,83 В | ||
| 2 Н 2 О O 2 + 4 H + + 4 e — | E o ox = -1,23 В |
Следующие катионы восстанавливаются труднее, чем вода: Li + ,
Rb + , K + , Cs + , Ba 2+ ,
Sr 2+ , Ca 2+ , Na + и Mg 2+ .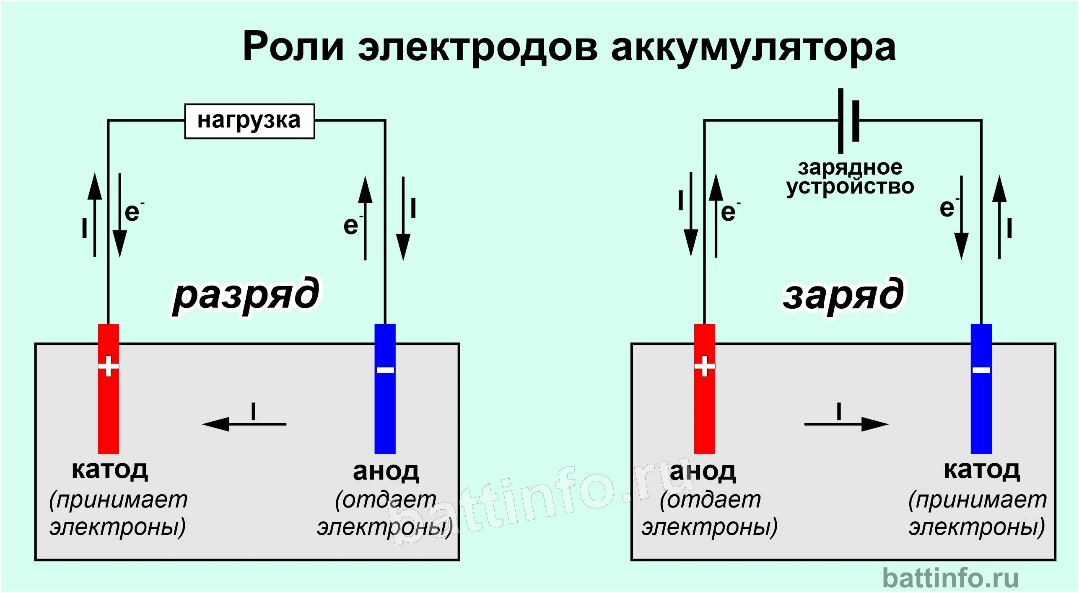
Два из этих катионов являются более вероятными кандидатами, чем другие.
потому что они образуют недорогие растворимые соли: Na + и
К + .
Ион SO 4 2- может быть лучшим анионом для
использовать, потому что это самый трудный анион для окисления.
потенциал окисления этого иона до пероксидисульфат-иона равен
-2,05 вольта.
| 2 SO 4 2- S 2 O 8 2- + 2 e — | E o ox = -2,05 В |
При водном растворе либо Na 2 SO 4
или K 2 SO 4 электролизуется в аппарате
показано на рисунке выше, H 2 скопление газа в одном
электрод и O 2 газ собирается на другом.
Что произойдет, если мы добавим такой индикатор, как бромтимол
синий к этому аппарату? Бромтимоловый синий желтеет в кислой среде.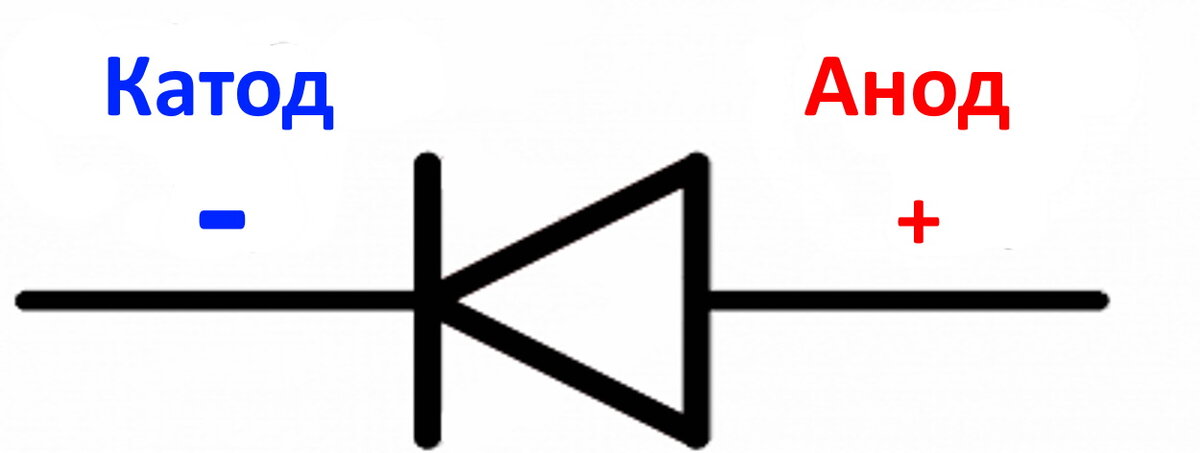
растворах (pH < 6) и синеву в основных растворах (pH > 7,6).
Согласно уравнениям двух полуреакций
индикатор должен стать желтым на аноде и синим на
катод.
| Катод (-): | 2 Н 2 О + 2 е — Н 2 + 2 ОХ — | ||
| Анод (+): | 2 Н 2 О O 2 + 4 H + + 4 e — |
Закон Фарадея
Закон Фарадея электролиза можно сформулировать следующим образом.
количество вещества, потребленного или произведенного на одном из
электродов в электролитической ячейке прямо пропорциональна
количество электричества, которое проходит через клетку.
Чтобы использовать закон Фарадея, мы должны признать
связь между током, временем и количеством электричества
заряд, протекающий по цепи.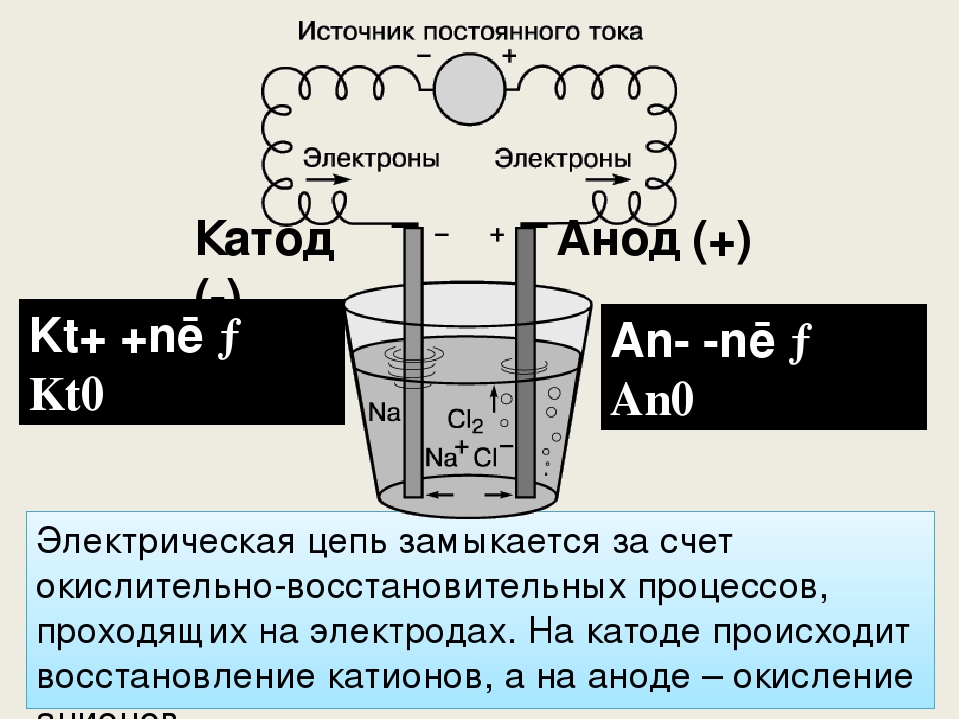 По определению один кулон
По определению один кулон
заряд передается при протекании тока силой 1 ампер в течение 1 секунды.
1 Кл = 1 ампер-с
Пример: Чтобы проиллюстрировать, как можно использовать закон Фарадея, давайте
рассчитать количество граммов металлического натрия, которое образуется при
катод при пропускании тока силой 10,0 ампер через расплавленный
натрия хлорида в течение 4 часов.
Начнем с расчета количества электрического заряда,
протекает через клетку.
Прежде чем мы сможем использовать эту информацию, нам нужен мост между
эта макроскопическая величина и явление, происходящее на
атомный масштаб. Этот мост представлен постоянной Фарадея,
который описывает количество кулонов заряда, переносимого
моль электронов.
Таким образом, количество молей электронов, перенесенных при
Через ячейку может пройти 144 000 Кл электрического заряда.
рассчитывается следующим образом.
Согласно сбалансированному уравнению реакции, которая
происходит на катоде этой ячейки, мы получаем один моль натрия за
каждый моль электронов.
| Катод (-): | На + + е — № |
Таким образом, мы получаем 1,49 моля или 34,3 г натрия в 4,00
часы.
Последствия этого вычисления
интересно. Нам пришлось бы проводить этот электролиз более
два дня, чтобы приготовить фунт натрия.
| Практическая задача 13: Рассчитать Нажмите Нажмите |
Мы можем расширить общую схему
изложенные в этом разделе, чтобы ответить на вопросы, которые могут показаться
невозможно на первый взгляд.
| Практическая задача 14: Определить Нажмите Нажмите |
что это, плюс или минус, определить полярность
Часто возникает проблема определить какой электрод является катодом, а какой анодом. Для начала нам нужно разобраться в терминах.
Содержание
- 1 Концепция катода и анода — простое объяснение
- 2 Электрохимические применения
- 2.
 1 Вакуумные электронные применения
1 Вакуумные электронные применения - 2.2. путаница?
- 2.5 Как определить анод и катод
- 2.6 Значение анода и катода
- 2.
Понятие катод и анод — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неравномерно. В результате взаимодействия частицы переходят от атома одного вещества к атому другого. Реакция называется окислительно-восстановительной реакцией. Потеря электронов называется окислением, элемент, отдающий электроны, называется восстановителем.
Присоединение электронов называется восстановлением; элемент, который принимает электроны в этом процессе, является окислителем. Перенос электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать как источник электрической энергии. Устройства, в которых энергия химической реакции преобразуется в электрическую, называются гальваническими элементами.
Простейший классический пример гальванического элемента представляет собой две пластины из разных металлов, погруженные в раствор электролита. В такой системе происходит окисление одного металла и восстановление другого.
В такой системе происходит окисление одного металла и восстановление другого.
ВАЖНО! Электрод, на котором происходит окисление, называется анодом. Электрод, на котором происходит восстановление, называется катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В приборе Якоби-Даниэля медная пластина помещается в раствор сульфата меди (медный электрод), а цинковая пластина погружается в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает в раствор катионы, создавая в нем избыточный положительный заряд, тогда как у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
Замыкание внешней цепи заставляет электроны течь от цинкового электрода к медному электроду. Равновесные отношения на границах фаз прерываются. Происходит окислительно-восстановительная реакция.
Энергия самопроизвольной химической реакции превращается в электрическую энергию.
Если химическая реакция вызвана внешней энергией электрического тока, то происходит процесс, называемый электролизом. Процессы, происходящие при электролизе, обратны тем, которые происходят при работе гальванического элемента.
ПРЕДУПРЕЖДЕНИЕ. Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод заряжен положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваника;
- Гальваника.
При электролизе расплавленных соединений и водных растворов получают металлы, очищают металлы от примесей и извлекают ценные компоненты (электролитическое рафинирование). Пластины отливают из металла, подлежащего рафинированию. Пластины помещаются в качестве анодов в электролизер. Металл растворяется электрическим током. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в исходной сырой металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролит, из которого удаляются. Медь, никель, свинец, золото, серебро и олово подвергаются электролитическому рафинированию.
Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в исходной сырой металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролит, из которого удаляются. Медь, никель, свинец, золото, серебро и олово подвергаются электролитическому рафинированию.
Электроэкстракция – это процесс извлечения металла из раствора при электролизе. Металл обрабатывается специальными реагентами, чтобы перевести его в раствор. В ходе процесса на катоде выделяется металл высокой чистоты. Так получают цинк, медь и кадмий.
Для предотвращения коррозии, придания прочности и украшения изделия поверхность одного металла покрывают слоем другого. Этот процесс называется гальванопокрытием.
Гальваника – это процесс изготовления металлических копий трехмерных объектов путем электроосаждения металла.
Использование в вакуумных электронных устройствах
Принцип действия катода и анода в вакуумном устройстве можно продемонстрировать на примере электронной лампы.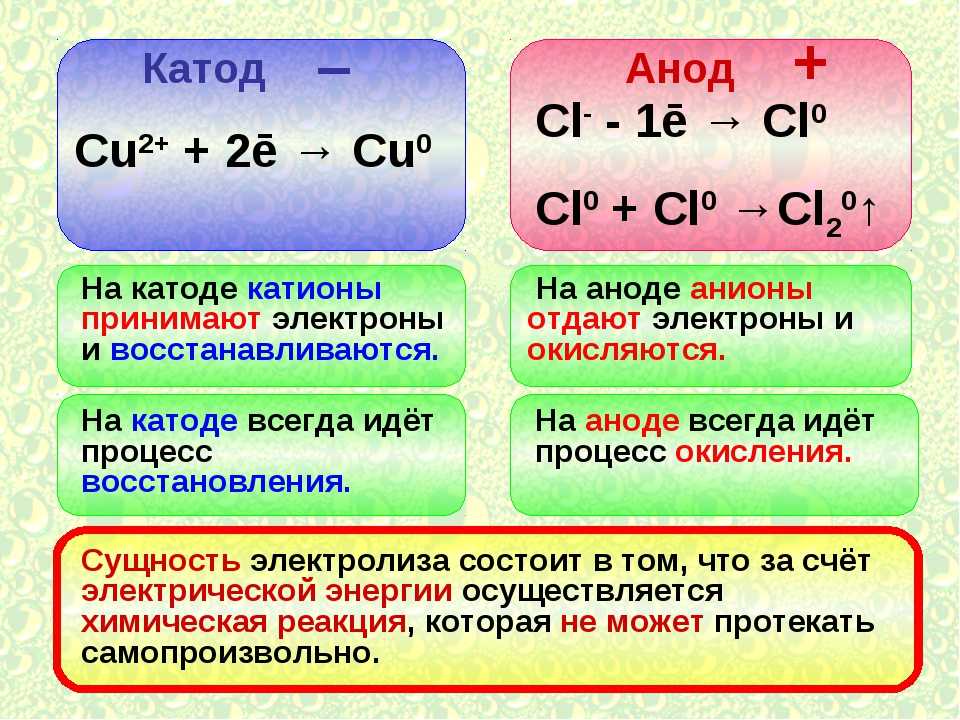 Он выглядит как герметически закрытый сосуд с металлическими деталями внутри. Устройство используется для выпрямления, генерации и преобразования электрических сигналов. По количеству электродов различают:
Он выглядит как герметически закрытый сосуд с металлическими деталями внутри. Устройство используется для выпрямления, генерации и преобразования электрических сигналов. По количеству электродов различают:
,
- ,
- диоды;
- триоды;
- тетрод;
- пентоды и т.д.
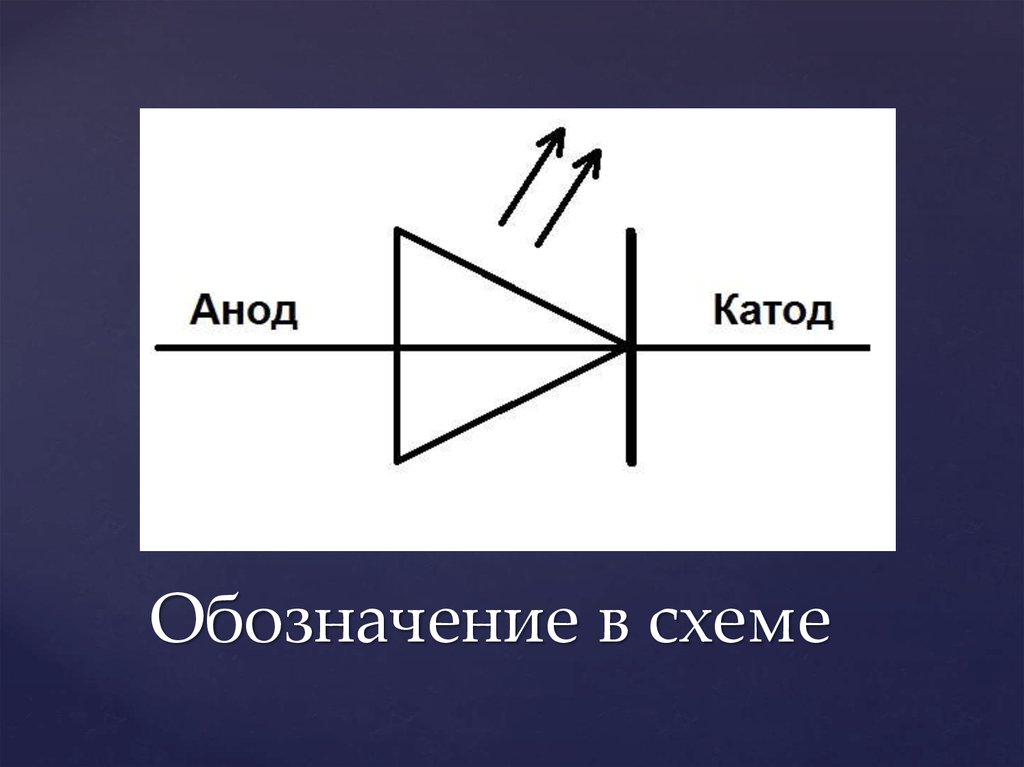
Диод представляет собой вакуумный прибор с двумя электродами, катодом и анодом. Катод подключается к отрицательному полюсу источника питания, анод к положительному полюсу. Назначение катода – испускать электроны под действием электрического тока, нагревая его до определенной температуры. За счет испускаемых электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер пространственного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Поток электронов регулируется с помощью дополнительных электродов путем подачи на них электрического потенциала. Диоды используются для преобразования переменного тока в постоянный.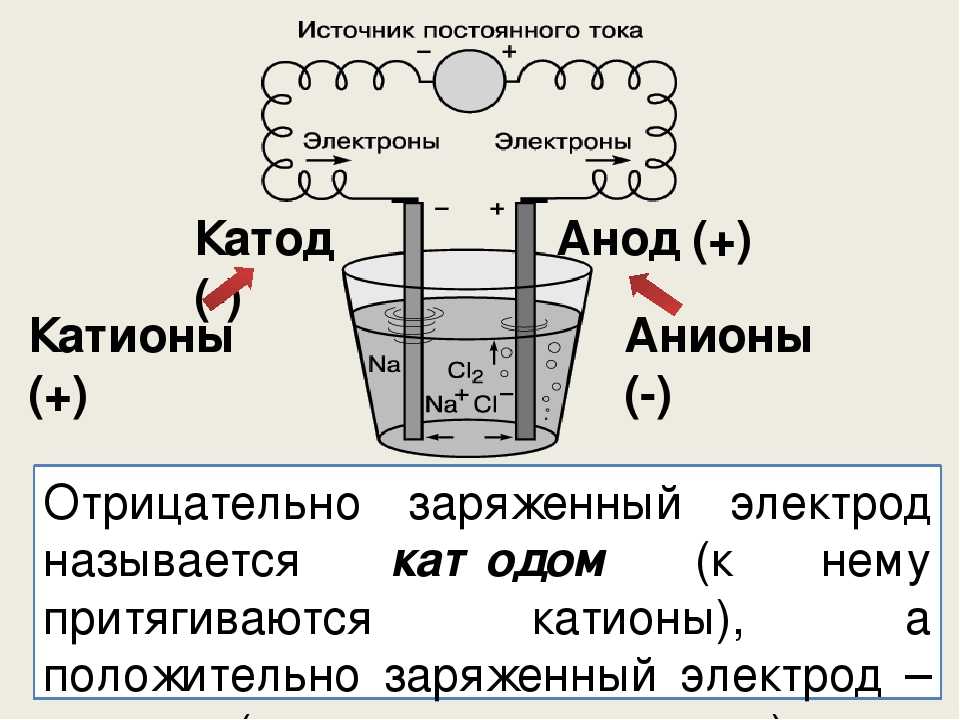
Применение в электронике
Сегодня используются полупроводниковые типы диодов.
Свойство диодов пропускать ток в прямом направлении и не пропускать ток в обратном направлении широко используется в электронике.
Работа светодиода основана на свойстве полупроводниковых кристаллов светиться при прохождении тока через p-n переход в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторными батареями: их перезаряжают и используют повторно.
При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдавая свои электроны, восстанавливая двуокись свинца, которая принимает электроны. Металлический свинец в батарее является анодом и заряжен отрицательно. Двуокись свинца является катодом и заряжена положительно.
При разрядке батареи расходуются вещества катода и анода и их электролит – серная кислота. Для зарядки аккумулятора его подключают к источнику тока (плюс к плюсу, минус к минусу). Направление тока теперь противоположно тому, что было при разряде аккумулятора. Электрохимические процессы на электродах «обратные». Теперь свинцовый электрод становится катодом, на нем происходит процесс восстановления, а диоксид свинца становится анодом, при этом происходит процедура окисления. Вещества, необходимые для работы батареи, снова создаются в батарее.
Для зарядки аккумулятора его подключают к источнику тока (плюс к плюсу, минус к минусу). Направление тока теперь противоположно тому, что было при разряде аккумулятора. Электрохимические процессы на электродах «обратные». Теперь свинцовый электрод становится катодом, на нем происходит процесс восстановления, а диоксид свинца становится анодом, при этом происходит процедура окисления. Вещества, необходимые для работы батареи, снова создаются в батарее.
Почему такая путаница?
Проблема возникает из-за того, что определенный знак заряда не может быть прочно прикреплен к аноду или катоду. Часто катод представляет собой положительно заряженный электрод, а анод — отрицательный электрод. Часто, но не всегда. Все зависит от процесса, происходящего на электроде.
ПРЕДУПРЕЖДЕНИЕ. Деталь, которую вы помещаете в электролит, может быть как анодом, так и катодом. Все зависит от цели процесса: нанести на него еще один слой металла или снять его.
 Цветовая маркировка проводов.»
Цветовая маркировка проводов.» 1 Вакуумные электронные применения
1 Вакуумные электронные применения