Энергия и мощность В повседневном употреблении в английском языке понятия «энергия» (‘energy’) и «мощность» (‘power’) часто смешиваются и используются как взаимозаменяемые. Однако в науке и инженерном деле значения этих понятий различаются. Мощность представляет собой изменение энергии в единицу времени (скорость изменения энергии) или работу, совершаемую в единицу времени. В системе СИ единицей мощности (и лучистого потока) является ватт (Вт), а единицей энергии, работы и количества теплоты является джоуль (Дж). Один ватт равен джоулю в секунду. Поэтому некорректно говорить, например, о мощности, потребленной или переданной за определенный период времени – за определенный период времени может быть потреблено или передано некоторое количество энергии. С точки зрения большинства практических применений, количество энергии, соответствующее одному джоулю, является очень малым. Поэтому при обсуждении промышленного производства энергии, а также потребления энергии оборудованием, системами и установками (и, как следствие, вопросов энергоэффективности в промышленности) обычно используются кратные единицы – килоджоуль (кДж), мегаджоуль (МДж) и гигаджоуль (ГДж). Основной единицей измерения производимой, потребляемой или передаваемой мощности является ватт. Однако, как и в случае с энергией, при обсуждении практических вопросов чаще используются кратные единицы мощности – киловатт (кВ), мегаватт (МВт) и гигаватт (ГВт)10. Некорректными являются выражения вида «мощность устройства составляет 100 ватт в час», поскольку ватт как единица мощности уже «содержит в себе» отнесение работы или энергии к периоду времени. Поэтому ватт и другие единицы мощности не должны сопровождаться отнесением к единице времени («в секунду», «в час» и т.п.), за исключением случаев, когда речь идет о приросте или снижении мощности с течением времени (подобно тому, как ускорение движения отражает «скорость» прироста или снижения скорости). В качестве внесистемной единицы энергии используется также ватт-час.В силу описанных выше причин на практике энергетическими компаниями и потребителями энергии чаще используются кратные единицы –киловатт-час(кВт•ч),мегаватт-час(МВт•ч) игигаватт-час(ГВт•ч)11. Одинкиловатт-часравен количеству энергии, используемому за один час при мощности один киловатт, и составляет 3,6 МДж. Использование внесистемной единицы,киловатт-часа,вместо мегаджоуля обусловлено, по всей видимости, историческими причинами и характерно для определенных отраслей и применений12. Другие единицы, используемые на практике, включают мегаватт электрической мощности (МВтэ) и мегаватт тепловой мощности (МВтт). Это внесистемные единицы, применение которых не является необходимым с теоретической точки зрения (Международное бюро мер и весов, МБМВ, считает их использование некорректным). Однако они применяются на практике, в особенности на предприятиях где производятся и/или используются оба вида энергии, например, на электростанциях или химических производствах, и важно избежать смешения этих видов при расчетах или в отчетности. 10Мощность, потребляемая процессором Pentium 4, составляет около 82 Вт. Человек, занятый тяжелым физическим трудом, развивает мощность около 500 Вт. Характерная механическая мощность автомобиля составляет 40–200кВт. Современныйдизель-электрическийлокомотив развивает механическую мощность около 3 МВт. 11Производство энергии на крупных электростанциях и энергопотребление крупных предприятий часто выражается в гигаватт-часах(ГВт·ч). Эта единица, равная миллионукиловатт-часов,используется потому, чтомегаватт-часявляется слишком малой единицей для этих целей. 12Один киловатт-часэквивалентен количеству энергии, производимому или потребляемому за один час при мощности один киловатт. 1кВт·ч = 1000 Вт · 3600 с = 3600000 ватт-с= 3600000 Дж = 3,6 МДжКиловатт-час(кВт·ч) является полезной единицей для выражения энергопотребления домохозяйств и малых предприятий. Типичное домохозяйство потребляет несколько сот киловатт-часовв месяц. Мегаваттчас (МВт·ч), равный 1000 кВт·ч, используется для выражения энергопотребления промышленных предприятий и производства энергии на электростанциях. studfiles.net При протекании термодинамического процесса в общем случае тела, участвующие в этом процессе, обмениваются между собой энергией. В результате этого обмена энергия одних тел увеличивается, а других - уменьшается. Передача энергии в процессе от одного тела к другому может происходить двумя способами. Первый способ передачи энергии реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел. При этом энергия передается от более нагретого тела к менее нагретому. Поскольку передача энергии этим способом происходит на молекулярном уровне без видимого движения тел, ее называют микрофизической формой передачи энергии. Количество энергии, переданной первым способом от одного тела к другому, называется количеством теплоты, или просто теплотой, а сам способ - передачей энергии в форме теплоты. Количество энергии, полученное телом в форме теплоты, называется подведенной теплотой, а количество энергии, отданное телом в форме теплоты, - отведенной теплотой. Теплота, так же как и любая другая энергия, измеряется в джоулях или килоджоулях /кДж/. Принято обозначать произвольное количество теплоты через Q, а удельное /отнесенное к 1кг/ - через q. Подведенная теплота считается положительной, а отведенная - отрицательной. Второй способ передачи энергии связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления. Иначе говоря, в этом случае передача энергии происходит при условии перемещения всего тела или его части в пространстве. Поэтому второй способ является макрофизической формой передачи энергии. Этот способ называется передачей энергии в форме работы, а количество переданной энергии в процессе - работой. Количество энергии, полученное телом в форме работы, будем называть совершенной над телом работой, а отданную энергию в форме работы - затраченной телом работой. Работа также измеряется в Дж или кДж. Затраченная телом работа считается положительной, а совершенная над телом работа - отрицательной. Произвольное количество энергии, переданное в форме работы, обозначают через L, а удельное - через l. В общем случае передача энергии в форме теплоты и в форме работы может происходить одновременно. При этом важно, что в различных термодинамических процессах, в зависимости от условий их протекания, количество теплоты и работы будет также различно. Следовательно, теплота и работа являются функциями процесса. Если процесса нет, то нет ни теплоты, ни работы. Таким образом, в термодинамическом процессе изменения состояния теплота и работа представляют собой два единственно возможных способа передачи энергии от одного тела к другому. Под идеальными понимают такие газы, в которых силы междумолекулярного притяжения и отталкивания отсутствуют, а сами молекулы, имея массу, не имеют объема. Любой реальный газ, давление которого мало (Р0), а удельный объем велик (v), близок по свойству к идеальному газу. В этом состоянии силы, действующие между молекулами реального газа, так же как и объем молекул по сравнению с объемом занимаемого газом пространства, весьма малы. Следует отметить, что не только при весьма малых давлениях, но и при обычных нормальных давлениях ряд газов (гелий, водород, азот, кислород) близки по своим свойствам к идеальным. Введение понятия об идеальном газе позволило составить простые математические зависимости, характеризующие состояние тела, и на основе законов для идеальных газов создать стройную теорию термодинамических процессов. К основным законам идеальных газов относятся законы Бойля-Мариотта, Гей-Люссака и Шарля. Идеальные газы полностью подчиняются этим законам. В 1664 году английским физиком Бойлем и в 1676 году французским химиком Мариоттом независимо друг от друга была установлена зависимость между удельным объемом и абсолютным давлением идеального газа в процессе, протекающем при постоянной температуре: T = const. При постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению: (2.1) или при T = const произведение удельного объема и давления есть величина постоянная: P1v1 = P2v2 , Pv = const (2.2) Графически в системе координат vP закон Бойля-Мариотта изображается равнобокой гиперболой. Эта кривая получила название изотермы (рис. 2.1), а процесс, протекающий при постоянной температуре, называется изотермическим. В 1802 году французским физиком Гей-Люссаком был открыт экспериментальным путем закон, устанавливающий зависимость между удельным объемом и абсолютной температурой в процессе, протекающем при постоянном давлении Р = const. При постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам: (2.3) Графически в системе координат vP закон Гей-Люссака изображается прямой, параллельной оси абсцисс. Эту прямую называют изобарой, а сам процесс, протекающий при постоянном давлении - изобарным. Рис. 2.1. Изотермический и изобарный процессы в vP-диаграмме studfiles.net Внутренняя энергия термодинамической системы может изменяться двумя способами: посредством совершения работы над системой и посредством теплообмена с окружающей средой. Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется коли́чеством теплоты́ или просто теплотой[1]. Теплота — это одна из основных термодинамических величин в классической феноменологической термодинамике. Количество теплоты входит в стандартные математические формулировки первого и второго начал термодинамики. Для изменения внутренней энергии системы посредством теплообмена также необходимо совершить работу. Однако это не механическая работа, которая связана с перемещением границы макроскопической системы. На микроскопическом уровне эта работа осуществляется силами, действующими между молекулами на границе контакта более нагретого тела с менее нагретым. Фактически при теплообмене энергия передаётся посредством электромагнитного взаимодействия при столкновениях молекул. Поэтому с точки зрения молекулярно-кинетической теории различие между работой и теплотой проявляется только в том, что совершение механической работы требует упорядоченного движения молекул на макроскопических масштабах, а передача энергии от более нагретого тела менее нагретому этого не требует. Энергия может также передаваться излучением от одного тела к другому и без их непосредственного контакта. Количество теплоты не является функцией состояния, и количество теплоты, полученное системой в каком-либо процессе, зависит от способа, которым она была переведена из начального состояния в конечное. Единица измерения в Международной системе единиц (СИ) — джоуль. Как единица измерения теплоты используется также калория. В Российской Федерации калория допущена к использованию в качестве внесистемной единицы без ограничения срока с областью применения «промышленность»[2]. Количество теплоты входит в математическую формулировку первого начала термодинамики, которую можно записать как Q=A+ΔU{\displaystyle Q=A+\Delta U} . Здесь ΔU{\displaystyle \Delta U} — изменение внутренней энергии системы, Q{\displaystyle Q} — количество теплоты, переданное системе, а A{\displaystyle A} — работа, совершённая системой. Однако определение теплоты должно указывать способ её измерения безотносительно к первому началу. Так как теплота — это энергия переданная в ходе теплообмена, для измерения количества теплоты необходимо пробное калориметрическое тело. По изменению внутренней энергии пробного тела можно будет судить о количестве теплоты, переданном от системы пробному телу. Без использования пробного тела первое начало теряет смысл содержательного закона и превращается в бесполезное для расчётов определение количества теплоты. Пусть в системе, состоящей из двух тел X{\displaystyle X} и Y{\displaystyle Y} , тело Y{\displaystyle Y} (пробное) заключено в жёсткую адиабатическую оболочку. Тогда оно не способно совершать макроскопическую работу, но может обмениваться энергией (то есть теплотой) с телом X{\displaystyle X} . Предположим, что тело X{\displaystyle X} также почти полностью заключено в адиабатическую, но не жёсткую оболочку, так что оно может совершать механическую работу, но обмениваться теплотой может лишь с Y{\displaystyle Y} . Количеством теплоты, переданным телу X{\displaystyle X} в некотором процессе, называется величина QX=−ΔUY{\displaystyle Q_{X}=-\Delta U_{Y}} , где ΔUY{\displaystyle \Delta U_{Y}} — изменение внутренней энергии тела Y{\displaystyle Y} . Согласно закону сохранения энергии, полная работа, выполненная системой, равна убыли полной внутренней энергии системы двух тел: A=−ΔUx−ΔUy{\displaystyle A=-\Delta U_{x}-\Delta U_{y}} , где A{\displaystyle A} — макроскопическая работа, совершенная телом X{\displaystyle X} , что позволяет записать это соотношение в форме первого начала термодинамики:Q=A+ΔUx{\displaystyle Q=A+\Delta U_{x}} . Таким образом, вводимое в феноменологической термодинамике количество теплоты может быть измерено посредством калориметрического тела (об изменении внутренней энергии которого можно судить по показанию соответствующего макроскопического прибора). Из первого начала термодинамики следует корректность введённого определения количества теплоты, то есть независимость соответствующей величины от выбора пробного тела Y{\displaystyle Y} и способа теплообмена между телами. При таком определении количества теплоты первое начало становится содержательным законом, допускающим экспериментальную проверку, так как все три величины, входящие в выражение для первого начала, могут быть измерены независимо[3]. Предположим, что рассматриваемое тело может обмениваться теплотой лишь с N{\displaystyle N} бесконечными тепловыми резервуарами, внутренняя энергия которых столь велика, что при рассматриваемом процессе температура каждого остаётся строго постоянной. Предположим, что над телом был совершён произвольный круговой процесс, то есть по окончании процесса оно находится абсолютно в том же состоянии, что и в начале. Пусть при этом за весь процесс оно заимствовало из i-го резервуара, находящегося при температуре Ti{\displaystyle T_{i}} , количество теплоты Qi{\displaystyle Q_{i}} . Тогда верно следующее неравенство Клаузиуса: Здесь ∘{\displaystyle \circ } обозначает круговой процесс. В общем случае теплообмена со средой переменной температуры неравенство принимает вид Здесь δQ(T){\displaystyle \delta Q(T)} — количество теплоты, переданное участком среды с (постоянной) температурой T{\displaystyle T} . Это неравенство применимо для любого процесса, совершаемого над телом. В частном случае квазистатического процесса оно переходит в равенство. Математически это означает, что для квазистатических процессов можно ввести функцию состояния, называемую энтропией, для которой Здесь T{\displaystyle T} — это абсолютная температура внешнего теплового резервуара. В этом смысле 1T{\displaystyle {\frac {1}{T}}} является интегрирующим множителем для количества теплоты, умножением на который получается полный дифференциал функции состояния. Для неквазистатических процессов такое определение энтропии не работает. Например, при адиабатическом расширении газа в пустоту однако энтропия при этом возрастает, в чём легко убедиться, переведя систему в начальное состояние квазистатически и воспользовавшись неравенством Клаузиуса. Кроме того, энтропия (в указанном смысле) не определена для неравновесных состояний системы, хотя во многих случаях систему можно считать локально равновесной и обладающей некоторым распределением энтропии. Внутренняя энергия системы, в которой возможны фазовые переходы или химические реакции, может изменяться и без изменения температуры. Например, энергия, передаваемая в систему, где жидкая вода находится в равновесии со льдом при нуле градусов Цельсия, расходуется на плавление льда, но температура при этом остаётся постоянной, пока весь лёд не превратится в воду. Такой способ передачи энергии традиционно называется «скрытой» или изотермической теплотой[4] (англ. latent heat), в отличие от «явной», «ощущаемой» или неизотермической теплоты (англ. sensible heat), под которой подразумевается процесс передачи энергии в систему, в результате которого изменяется лишь температура системы, но не её состав. Энергия, необходимая для фазового перехода единицы массы вещества, называется удельной теплотой фазового превращения[5]. В соответствии с физическим процессом, имеющим место при фазовом превращении, могут выделять теплоту плавления, теплоту испарения, теплоту сублимации (возгонки), теплоту перекристаллизации и т. д. Фазовые превращения идут со скачкообразным изменением энтропии, что сопровождается выделением или поглощением тепла, несмотря на постоянство температуры. Многие понятия термодинамики возникли в связи с устаревшей теорией теплорода, которая сошла со сцены после выяснения молекулярно-кинетических основ термодинамики. С тех пор они используются и в научном, и в повседневном языке. Хотя в строгом смысле теплота представляет собой один из способов передачи энергии, и физический смысл имеет лишь количество энергии, переданное системе, слово «тепло-» входит в такие устоявшиеся научные понятия, как поток тепла, теплоёмкость, теплота фазового перехода, теплота химической реакции, теплопроводность и пр. Поэтому там, где такое словоупотребление не вводит в заблуждение, понятия «теплота» и «количество теплоты» синонимичны[6]. Однако этими терминами можно пользоваться только при условии, что им дано точное определение, не связанное с представлениями теории теплорода, и ни в коем случае «количество теплоты» нельзя относить к числу первоначальных понятий, не требующих определения[7]. Поэтому некоторые авторы уточняют, что во избежание ошибок теории теплорода под понятием «теплота» следует понимать именно способ передачи энергии, а количество переданной этим способом энергии обозначают понятием «количество теплоты»[8]. Рекомендуется избегать такого термина, как «тепловая энергия», который по смыслу совпадает с внутренней энергией[9]. ru-wiki.org Любая термодинамическая система состоит из атомов и молекул, находящихся в непрерывном движении. Количественной характеристикой движения является энергия. Внутренняя энергия (U) характеризует общий запас энергии системы. Она включает все виды движения и взаимодействия частиц, составляющих систему: кинетическую энергию молекулярного движения, межмолекулярную энергию притяжения и отталкивания частиц, внутримолекулярную или химическую энергию, энергию электронного возбуждения, внутриядерную и лучистую энергию. Величина внутренней энергии зависит от природы вещества, его массы и параметров состояния системы. Определение полного запаса внутренней энергии вещества невозможно, т.к. нельзя перевести систему в состояние, лишенное внутренней энергии. Поэтому в термодинамике рассматривают изменение внутренней энергии (∆U), которое представляет собой разность величин внутренней энергии системы в конечном и начальном состояниях: ∆U = Ukoh. – Uнач. Бесконечно малое изменение внутренней энергии обозначают через du т.к. внутренняя энергия является функцией состояния и ее изменение не зависит от пути процесса, а определяется только начальным и конечным состоянием системы, то du будет полным дифференциалом. Величины ∆U и du считают положительными, если внутренняя энергия при протекании процесса возрастает, а отрицательными если убывает. Передача энергии от системы к окружающей среде и наоборот осуществляется в виде теплоты (Q) и работы (А). Система -Q +Q +А -А Окружающая среда Форма передачи энергии от одной части системы к другой вследствие неупорядоченного движения молекул, зависящая лишь от температуры частей системы и не связанная с перекосом вещества в системе называется теплотой. Теплота связана с процессом, а не с состоянием системы, т.е. теплота является функцией состояния она зависит от пути процесса поэтому бесконечно малое количество теплоты обозначается δQ и не является полным дифференциалом. Теплота, подводимая к системе, считается положительной, а отданная ею - отрицательной. Работа процесса - это энергия, передаваемая одним телом другому при их взаимодействии, не зависящая от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Работа, как и теплота, связана с процессом и не является свойством системы, т.е. функцией состояния. Paбoту, совершаемую системой против внешних сил. принято считать положительной, а совершаемую над системой - отрицательной. Первый закон имеет несколько формулировок: Внутренняя энергия изолированной системы постоянна. Работа и теплота эквивалентны. Вечный двигатель I рода невозможен. (Двигатель I рода дает работу без затраты энергии из окружающей среды.) Математическое выражение I закона: Q = ∆U + A, (1) где Q - количество сообщенной системе теплоты; ∆U - изменение внутренней энергии; А - суммарная работа, совершаемая системой. Для бесконечно малых элементарных процессов уравнение (1) имеет вид: δQ = du – δА = du - pdV + δА, где pdV - работа расширения; δА - сумма всех остальных видов элементарных работ (магнитная, электрическая и др.). Величину δА называют полезной работой. В химической термодинамике принимают во внимание только работу расширения, а работу δА считают равной 0. Поэтому δА = pdV, тогда δQ= du + pdV (2) Из уравнений (1.2) следует, что количество, теплоты подведенное к системе или отведенное от нее идет на изменение внутренней энергии и на работу, совершаемую системой или совершаемую над системой. studfiles.net Функциями состояния называются сложные физические величины,неподдающиеся непосредственному измерению и вычисляемые через пара-метры состояния. В технической термодинамике используются следующие функции состояния: внутренняя энергия, энтальпия, энтропия. Параметры и функции состояния газов всегда имеют одно и то же значение в данном состоянии независимо от того, достигнуто ли оно в процессе охлаждения или нагревания, расширения или сжатия газа. Внутренней энергиейUназывается запас энергии,которым обладаеттело в состоянии равновесия. В процессах, изучаемых технической термо-динамикой, изменение внутренней энергии происходит за счет изменения запаса внутренней тепловой энергии тела, которая представляет собой сумму кинетической энергии поступательного, вращательного и колеба-тельного движения молекул вещества и потенциальной энергии их взаимо-действия. Внутренняя кинетическая энергия зависит от температуры тела и увеличивается при ее повышении. Внутренняя потенциальная энергия за-висит от расстояния между молекулами и увеличивается при их сближе-нии, т. е. она зависит от давления и плотности. Таким образом, внутренняя энергия является функцией параметров, определяющих состояние тела. В случае идеальных газов, в которых отсутствуют силы взаимодействия молекул, изменение внутренней энергии будет обусловлено только изме-нением кинетической энергии движения молекул, т. е. для идеального газа U=f(Т). Энтальпия.Макроскопические тела,свойства и поведение которыхизучается термодинамикой, находятся во взаимодействии с окружающими их телами. Совокупность внутренней энергии тела и энергии внешнего взаимодействия тела с окружающей средой объединяется понятием «эн- где U — внутренняя энергия системы; рV — потенциальная энергия давле-ния среды на систему, выраженная в параметрах системы. Из уравнения состояния идеального газа (2.5) произведение рV можно Энтальпия идеального газа зависит только от его температуры, т. е. I = f (Т). Внутренняя энергия и энтальпия, отнесенные к единице массы веще-ства, называются удельными (u и i), единицей измерения которых служит Дж/кг.21 Энтропияявляется признаком обмена энергией в форме теплоты.Из-менение величины энтропии характеризует наличие теплообмена между системой и окружающей средой. При подводе теплоты к телу его энтропия возрастает, при отводе — уменьшается. Энтропия изолированной системы, находящейся в равновесии, остается неизменной. Энтропия обозначается через S и имеет размерность Дж/К; удельная энтропия — через s, ее размерность Дж/(кг·К). Функции состояния u, i, s являются положительными величинами. В изучаемых технической термодинамикой процессах обычно не требуется определение их абсолютных значений, а достаточно определить только изменение этих величин. Поэтому за начало отсчета для u, i, s можно при-нять любое произвольное состояние системы. В термодинамике условно принято, что значения внутренней энергии, энтальпии и энтропии при нормальных физических условиях равны нулю. Работа,совершаемая при изменении состояния газа,вычисляется поформуле где р — давление газа, характеризующее силу воздействия газа на окру-жающую среду, Па; V — изменение объема газа, характеризующее меха-ническое перемещение границ тела, м3. Давление в термодинамической системе есть причина совершения ра-боты. Расширение или сжатие газа возможно только тогда, когда давление системы отличается от давления окружающей среды. Признаком соверше-ния работы служит изменение объема системы. Работа положительна, если газ расширяется, и отрицательна, если газ сжимается. Для графического изображения работы применяется диаграмма, назы-ваемая рабочей, где количество работы измеряется площадью, расположенной над кривой изменения объема рабочего тела в процессе (рис. 2.1). Рис. 2.1. Графическое изображение работы газа (рабочая диаграмма) Теплота.Количество теплоты,которой система обменивается с окру-жающей средой при изменении ее состояния, определяется из выражения где Т — температура; S — изменение энтропии системы. Температура в процессах, сопровождающихся теплообменом, являет-ся причиной обмена энергией в форме теплоты. Обмен теплотой между те-лами возможен только при наличии разности температур. Признаком теплообмена является изменение энтропии. Увеличение энтропии свидетельствует о подводе теплоты к системе (теплота положи-тельна), уменьшение — об отводе теплоты из системы (теплота отрица-тельна), постоянство энтропии — об отсутствии теплообмена. Для графического изображения количества теплоты применяется диа-грамма, называемая тепловой, где количество теплоты измеряется площа-дью под кривой изменения энтропии при изменении состояния тела (рис. 2.2). Работа и теплота, отнесенные к 1 кг газа, обозначаются строчны-ми символами соответственно l и q и измеряются в Дж/кг. Состояние системы в pv- и TS-диаграммах изображается точкой, а процесс — кривой перехода ее из начального состояния в конечное. На рис. 2.3 переходы системы из состояния А в состояние В осуществ-ляются различными путями: по кривой АDВ и АСВ. Площади под этими кривыми различны, следовательно, различны и количества работы и теп-лоты. В то же время начальное и конечное состояния системы в обоих процессах одинаково (точки А и В). Таким образом, работа и теплота проявляются только в процессе из-менения состояния и зависят от характера процесса. В термодинамической системе основную роль играет изменение внут-ренней энергии, выражающееся в количестве работы и теплоты, которыми она обменивается с окружающей средой. При этом система увеличивает свою внутреннюю энергию, если теплота подводится к ней (или над ней совершается работа) и уменьшает свою внутреннюю энергию, если она от-дает теплоту в окружающую среду (или она совершает работу над окру-жающей средой). Это положение составляет содержание первого закона термодина- мики: т. е. изменение внутренней энергии системы равно разности между коли-чеством теплоты и работы, которыми система обменивается с окружающей средой. Другими словами, вся подведенная к рабочему телу теплота расхо- дуется на изменение внутренней энергии и на совершение работы из-менения объема: Из уравнения первого начала термодинамики следует, что невозмож-но создать вечный двигатель первого рода, т. е. двигатель, который произ-водил бы работу без затрат энергии. Единицей измерения всех видов энергии, в том числе работы и тепло-ты, служит джоуль (Дж). Количество энергии, полученное в единицу вре-мени (секунду), называют мощностью и измеряют в ваттах (Вт=Дж/с). Функции состояния. Работа и теплота. Первое начало термодинамики. Теплота и мощность
1.2. Понятие энергии и законы термодинамики
Теплота и работа как формы передачи энергии.
Идеальные и реальные газы
2.1 Определения и основные законы идеальных газов.
Теплота — WiKi
Определение
Неравенство Клаузиуса. Энтропия
Скрытая и ощущаемая теплота
Теплота фазового превращения
О терминах «теплота», «количество теплоты», «тепловая энергия»
Примечания
Литература
Внутренняя энергия
Теплота и работа
Первый закон термодинамики
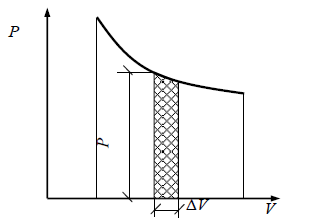
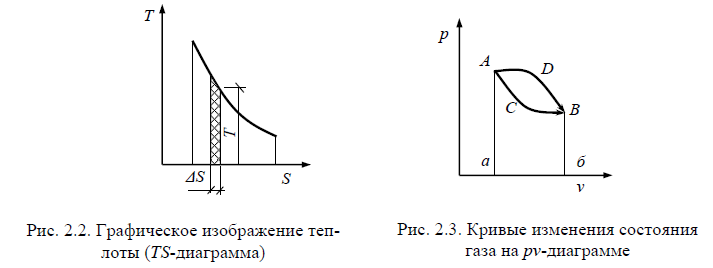
Функции состояния. Работа и теплота. Первое начало термодинамики
тальпия».
В математической записи энтальпия определяется выражением

заменить на RТ, и тогда




 где Q — подводимая или обводимая теплота;
где Q — подводимая или обводимая теплота;
U —изменение внутренней
энергии; L — работа изменения объема.
Похожие статьи:
poznayka.org
Лекция 2. Первый закон термодинамики. Теплота. Работа. Внутренняя энергия
Теплота – энергия, передающаяся путем теплового (неупорядоченного) движения молекул.
Работа – путем упорядоченного движения молекул.
Внутренняя энергия – энергия взаимодействия всех частиц.
Все величины являются энергией и измеряются в джоулях.
Первый закон термодинамики
Теплота, подведенная к системе, расходуется на изменение внутренней энергии и совершение работы:
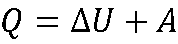
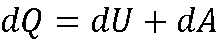
Первый закон термодинамики – частный вид закона сохранения энергии.
Свойства теплоты, работы, внутренней энергии
-
Теплота и работа – функции процесса:
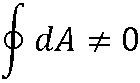
Внутренняя энергия – функция состояния:
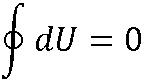
-
dA, dQ не являются полными дифференциалами.
dU является полным
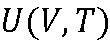 :
: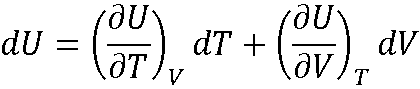
- Функции процесса
-
Сходные по формуле выражения
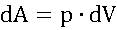

- Теплота меняет тепловую энергию системы, работа – все виды энергии
- Работа полностью переходит в теплоту, теплота не полностью переходит в работу
| Сходство теплоты и работы | Различие теплоты и работы |
| | |
Доказательство того, что внутренняя энергия является функцией состояния
Сохранение энергии: 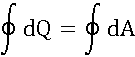
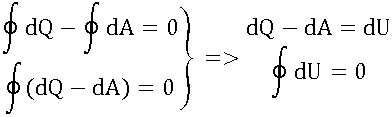
studentoriy.ru
ТЕПЛОТА - это... Что такое ТЕПЛОТА?
где q - тепловой поток, k - коэффициент теплопроводности, а A - площадь поперечного сечения. Это соотношение называется законом теплопроводности Фурье; знак "минус" в нем указывает на то, что теплота передается в направлении, обратном градиенту температуры. Из закона Фурье следует, что тепловой поток можно понизить, уменьшив одну из величин - коэффициент теплопроводности, площадь или градиент температуры. Для здания в зимних условиях последние величины практически постоянны, а поэтому для поддержания в помещении нужной температуры остается уменьшать теплопроводность стен, т.е. улучшать их теплоизоляцию. В таблице представлены коэффициенты теплопроводности некоторых веществ и материалов. Из таблицы видно, что одни металлы проводят тепло гораздо лучше других, но все они являются значительно лучшими проводниками тепла, чем воздух и пористые материалы.ТЕПЛОПРОВОДНОСТЬ НЕКОТОРЫХ ВЕЩЕСТВ И МАТЕРИАЛОВ Вещества и материалы Теплопроводность, Вт/(м? К)МеталлыАлюминий ___________________205Бронза _____________________105Висмут _______________________8,4Вольфрам ___________________159Железо ______________________67Золото _____________________287Кадмий ______________________96Магний _____________________155Медь _______________________389Мышьяк _____________________188Никель ______________________58Платина _____________________70Ртуть ________________________7Свинец ______________________35Цинк _______________________113
Другие материалыАсбест _______________________0,08Бетон ________________________0,59Воздух _______________________0,024Гагачий пух (неплотный) ______0,008Дерево (орех) ________________0,209Магнезия (MgO) _______________0,10Опилки _______________________0,059Резина (губчатая) ____________0,038Слюда ________________________0,42Стекло _______________________0,75Углерод (графит) ____________15,6
Теплопроводность металлов обусловлена колебаниями кристаллической решетки и движением большого числа свободных электронов (называемых иногда электронным газом). Движение электронов ответственно и за электропроводность металлов, а потому неудивительно, что хорошие проводники тепла (например, серебро или медь) являются также хорошими проводниками электричества. Тепловое и электрическое сопротивление многих веществ резко уменьшается при понижении температуры ниже температуры жидкого гелия (1,8 K). Это явление, называемое сверхпроводимостью, используется для повышения эффективности работы многих устройств - от приборов микроэлектроники до линий электропередачи и больших электромагнитов.См. также СВЕРХПРОВОДИМОСТЬ.Конвекция. Как мы уже говорили, при подводе тепла к жидкости или газу увеличивается интенсивность движения молекул, а вследствие этого повышается давление. Если жидкость или газ не ограничены в объеме, то они расширяются; локальная плотность жидкости (газа) становится меньше, и благодаря выталкивающим (архимедовым) силам нагретая часть среды движется вверх (именно поэтому теплый воздух в комнате поднимается от батарей к потолку). Данное явление называется конвекцией. Чтобы не расходовать тепло отопительной системы впустую, нужно пользоваться современными обогревателями, обеспечивающими принудительную циркуляцию воздуха. Конвективный тепловой поток от нагревателя к нагреваемой среде зависит от начальной скорости движения молекул, плотности, вязкости, теплопроводности и теплоемкости и среды; очень важны также размер и форма нагревателя. Соотношение между соответствующими величинами подчиняется закону Ньютона q = hA (TW - TҐ), где q - тепловой поток (измеряемый в ваттах), A - площадь поверхности источника тепла (в м2), TW и TҐ - температуры источника и его окружения (в кельвинах). Коэффициент конвективного теплопереноса h зависит от свойств среды, начальной скорости ее молекул, а также от формы источника тепла, и измеряется в единицах Вт/(м2*К). Величина h неодинакова для случаев, когда воздух вокруг нагревателя неподвижен (свободная конвекция) и когда тот же нагреватель находится в воздушном потоке (вынужденная конвекция). В простых случаях течения жидкости по трубе или обтекания плоской поверхности коэффициент h можно рассчитать теоретически. Однако найти аналитическое решение задачи о конвекции для турбулентного течения среды пока не удается. Турбулентность - это сложное движение жидкости (газа), хаотичное в масштабах, существенно превышающих молекулярные. Если нагретое (или, наоборот, холодное) тело поместить в неподвижную среду или в поток, то вокруг него образуются конвективные токи и пограничный слой. Температура, давление и скорость движения молекул в этом слое играют важную роль при определении коэффициента конвективного теплопереноса. Конвекцию необходимо учитывать при проектировании теплообменников, систем кондиционирования воздуха, высокоскоростных летательных аппаратов и многих других устройств. Во всех подобных системах одновременно с конвекцией имеет место теплопроводность, причем как между твердыми телами, так и в окружающей их среде. При повышенных температурах существенную роль может играть и лучистый теплообмен.Лучистый теплообмен. Третий вид теплопередачи - лучистый теплообмен - отличается от теплопроводности и конвекции тем, что теплота в этом случае может передаваться через вакуум. Сходство же его с другими способами передачи тепла в том, что он тоже обусловлен разностью температур. Тепловое излучение - это один из видов электромагнитного излучения. Другие его виды - радиоволновое, ультрафиолетовое и гамма-излучения - возникают в отсутствие разности температур. На рис. 8 представлена зависимость энергии теплового (инфракрасного) излучения от длины волны. Тепловое излучение может сопровождаться испусканием видимого света, но его энергия мала по сравнению с энергией излучения невидимой части спектра.Рис. 8. РАСПРЕДЕЛЕНИЕ ЭНЕРГИИ теплового излучения по длинам волн при двух разных температурах. Интенсивность теплопередачи путем теплопроводности и конвекции пропорциональна температуре, а лучистый тепловой поток пропорционален четвертой степени температуры и подчиняется закону Стефана - Больцмана где, как и ранее, q - тепловой поток (в джоулях в секунду, т.е. в Вт), A - площадь поверхности излучающего тела (в м2), а T1 и T2 - температуры (в кельвинах) излучающего тела и окружения, поглощающего это излучение. Коэффициент s называется постоянной Стефана - Больцмана и равен (5,66961 ± 0,00096)*10-8 Вт/(м2 * К4). Представленный закон теплового излучения справедлив лишь для идеального излучателя - так называемого абсолютно черного тела. Ни одно реальное тело таковым не является, хотя плоская черная поверхность по своим свойствам приближается к абсолютно черному телу. Светлые же поверхности излучают сравнительно слабо. Чтобы учесть отклонение от идеальности многочисленных "серых" тел, в правую часть выражения, описывающего закон Стефана - Больцмана, вводят коэффициент, меньший единицы, называемый излучательной способностью. Для плоской черной поверхности этот коэффициент может достигать 0,98, а для полированного металлического зеркала не превышает 0,05. Соответственно лучепоглощательная способность высока для черного тела и низка для зеркального. Жилые и офисные помещения часто обогревают небольшими электрическими теплоизлучателями; красноватое свечение их спиралей - это видимое тепловое излучение, близкое к границе инфракрасной части спектра. Помещение же обогревается теплотой, которую несет в основном невидимая, инфракрасная часть излучения. В приборах ночного видения применяются источник теплового излучения и приемник, чувствительный к ИК-излучению, позволяющий видеть в темноте. Мощным излучателем тепловой энергии является Солнце; оно нагревает Землю даже на расстоянии 150 млн. км. Интенсивность солнечного излучения, регистрируемая год за годом станциями, расположенными во многих точках земного шара, составляет примерно 1,37 Вт/м2. Солнечная энергия - источник жизни на Земле. Ведутся поиски способов наиболее эффективного ее использования. Созданы солнечные батареи, позволяющие обогревать дома и получать электроэнергию для бытовых нужд. РОЛЬ ТЕПЛОТЫ И ЕЕ ИСПОЛЬЗОВАНИЕ Глобальные процессы теплообмена не сводятся к нагреванию Земли солнечным излучением. Массивными конвекционными потоками в атмосфере определяются суточные изменения погодных условий на всем земном шаре. Перепады температуры в атмосфере между экваториальными и полярными областями совместно с кориолисовыми силами, обусловленными вращением Земли, приводят к появлению непрерывно изменяющихся конвекционных потоков, таких, как пассаты, струйные течения, а также теплые и холодные фронты.См. такжеКЛИМАТ;МЕТЕОРОЛОГИЯ И КЛИМАТОЛОГИЯ. Перенос тепла (за счет теплопроводности) от расплавленного ядра Земли к ее поверхности приводит к извержению вулканов и появлению гейзеров. В некоторых регионах геотермальная энергия используется для обогрева помещений и выработки электроэнергии. Теплота - непременный участник почти всех производственных процессов. Упомянем такие наиболее важные из них, как выплавка и обработка металлов, работа двигателей, производство пищевых продуктов, химический синтез, переработка нефти, изготовление самых разных предметов - от кирпичей и посуды до автомобилей и электронных устройств. Многие промышленные производства и транспорт, а также теплоэлектростанции не могли бы работать без тепловых машин - устройств, преобразующих теплоту в полезную работу. Примерами таких машин могут служить компрессоры, турбины, паровые, бензиновые и реактивные двигатели. Одной из наиболее известных тепловых машин является паровая турбина, в которой реализуется часть цикла Ранкина, используемого на современных электростанциях. Упрощенная схема этого цикла представлена на рис. 9. Рабочую жидкость - воду - превращают в перегретый пар в паровом котле, нагреваемом за счет сжигания ископаемого топлива (угля, нефти или природного газа). Пар высокого давления вращает вал паровой турбины, которая приводит в действие генератор, вырабатывающий электроэнергию. Отработанный пар конденсируется при охлаждении проточной водой, которая поглощает часть теплоты, не использованной в цикле Ранкина. Далее вода подается в охлаждающую башню (градирню), откуда часть тепла уходит в атмосферу. Конденсат с помощью насоса возвращают в паровой котел, и весь цикл повторяется.Рис. 9. УПРОЩЕННАЯ СХЕМА РАБОЧЕГО ЦИКЛА паротурбинной электростанции, работающей на ископаемом топливе. Все процессы в цикле Ранкина иллюстрируют описанные выше начала термодинамики. В частности, согласно второму началу, часть энергии, потребляемой электростанцией, должно рассеиваться в окружающей среде в виде теплоты. Оказывается, что таким образом теряется примерно 68% энергии, первоначально содержавшейся в ископаемом топливе. Заметного повышения КПД электростанции можно было бы достигнуть, лишь повысив температуру парового котла (которая лимитируется жаропрочностью материалов) или понизив температуру среды, куда уходит тепло, т.е. атмосферы. Другой термодинамический цикл, имеющий большое значение в нашей повседневной жизни, - это парокомпрессорный холодильный цикл Ранкина, схема которого представлена на рис. 10. В холодильниках и бытовых кондиционерах энергия для его обеспечения подводится извне. Компрессор повышает температуру и давление рабочего вещества холодильника - фреона, аммиака или углекислого газа. Перегретый газ подается в конденсатор, где охлаждается и конденсируется, отдавая тепло окружающей среде. Жидкость, выходящая из патрубков конденсатора, проходит через дросселирующий клапан в испаритель, и часть ее испаряется, что сопровождается резким понижением температуры. Испаритель отбирает у камеры холодильника тепло, которое нагревает рабочую жидкость в патрубках; эта жидкость подается компрессором в конденсатор, и цикл снова повторяется.Рис. 10. УПРОЩЕННАЯ СХЕМА ХОЛОДИЛЬНОГО ЦИКЛА. Холодильный цикл, представленный на рис. 10, можно использовать и в тепловом насосе. Такие тепловые насосы летом отдают тепло горячему атмосферному воздуху и кондиционируют помещение, а зимой, наоборот, отбирают тепло у холодного воздуха и обогревают помещение. Важным источником теплоты для таких целей, как производство электроэнергии и транспортные перевозки, служат ядерные реакции. В 1905 А.Эйнштейн показал, что масса и энергия связаны соотношением E = mc2, т.е. могут переходить друг в друга. Скорость света c очень велика: 300 тыс. км/с. Это означает, что даже малое количество вещества может дать огромное количество энергии. Так, из 1 кг делящегося вещества (например, урана) теоретически можно получить энергию, которую за 1000 суток непрерывной работы дает электростанция мощностью 1 МВт. См. такжеАТОМА СТРОЕНИЕ;ПЕЧЕЙ И ТОПОК ТЕХНОЛОГИЯ;ЭЛЕКТРОМАГНИТНОЕ ИЗЛУЧЕНИЕ;ТЕПЛООБМЕННИК;ТУРБИНА;ЕДИНИЦЫ ИЗМЕРЕНИЯ ФИЗИЧЕСКИХ ВЕЛИЧИН.ЛИТЕРАТУРА Земанский М. Температуры очень высокие и очень низкие. М., 1968 Поль Р. Механика, акустика и учение о теплоте. М., 1971 Смородинский Я.А. Температура. М., 1981 Фен Дж. Машины, энергия и энтропия. М., 1986 Эткинс П.В. Порядок и беспорядок в природе. М., 1987Энциклопедия Кольера. — Открытое общество. 2000.
Синонимы:- ФИЗИКА ТВЕРДОГО ТЕЛА
- ТЕРМОЭЛЕКТРОННАЯ ЭМИССИЯ
Смотреть что такое "ТЕПЛОТА" в других словарях:
теплота́ — теплота, ы … Русское словесное ударение
ТЕПЛОТА — ТЕПЛОТА, теплоты, мн. нет, жен. 1. отвлеч. сущ. к теплый в 1 знач. Теплота тела. Теплота воздуха. || Исходящее от чего нибудь тепло (см. тепло1 во 2 знач.). «Оно (солнце) своею теплотой огромные дубы и недра согревает.» Крылов. 2. перен. Доброе,… … Толковый словарь Ушакова
теплота — ы; ж. 1. к Тёплый. Т. солнца, воды, воздуха. Т. дня. Т. рук. Т. шубы. Т. дома. Т. встречи. Т. души, взгляда, сердца. Любить теплоту. 2. = Тепло (1 2, 5 зн.). Лучистая т. Присутствие, наличие теплоты. Единицы измерения теплоты. Превращение… … Энциклопедический словарь
ТЕПЛОТА — (1) энергетическая характеристика процесса теплообмена, при котором рассматриваемое тело получает (отдает) энергию. Т. в отличие от внутренней энергии является функцией процесса, а не состояния. Её количественной мерой служит количество теплоты… … Большая политехническая энциклопедия
Теплота — один из двух, известных современному естествознанию, способов передачи энергии мера передачи неупорядоченного движения. Количество переданной энергии называют количеством теплоты. В узком смысле о теплоте можно говорить как об энергии,… … Википедия
ТЕПЛОТА — (количество теплоты) энергетическая характеристика процесса теплообмена, определяется количеством энергии, которое получает (отдает) тело (физическая система) в процессе теплообмена. Теплота функция процесса: количество сообщенной телу теплоты… … Большой Энциклопедический словарь
Теплота — ж. 1. Форма движения материи, представляющая собою беспорядочное движение образующих тело микрочастиц (молекул, атомов, электронов и т.п.). отт. Энергия, создаваемая таким движением; теплота 1.. 2. Нагретое состояние кого либо или чего либо;… … Современный толковый словарь русского языка Ефремовой
ТЕПЛОТА — ТЕПЛОТА, ы, жен. 1. см. теплый. 2. Форма движения материи беспорядочное движение частиц тела; энергетическая характеристика теплообмена, определяющаяся количеством энергии, к рое получает нагреваемое тело (отдает охлаждаемое тело) (спец.). Т.… … Толковый словарь Ожегова
теплота — приветливость, мягкость, жар, тепло, нежность, ласковость, ласка Словарь русских синонимов. теплота сущ., кол во синонимов: 9 • жар (39) • ласка … Словарь синонимов
ТЕПЛОТА — ТЕПЛОТА. Непосредственное ощущение позволяет различать холодные тела от теплых. Более точно можно определить состояние тела, используя изменения, которые испытывают вещества при действии теплоты: можно использовать расширение тел в зависимости от … Большая медицинская энциклопедия
теплота — процесса; теплота Энергия, передаваемая одним телом другому при их взаимодействии, зависящая только от температуры этих тел и не связанная с переносом вещества от одного тела к другому. Энергия, передаваемая более нагретым телом менее нагретому,… … Политехнический терминологический толковый словарь
dic.academic.ru










Поделиться с друзьями: